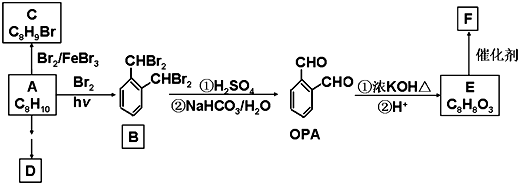
题目内容
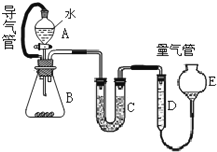 在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧.一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验.取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M.将M研细后称取 4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过图测量生成的气体体积,进而推算白色固体的成分.
在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧.一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验.取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M.将M研细后称取 4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过图测量生成的气体体积,进而推算白色固体的成分.(1)用洁净铂丝蘸取CaCl2溶液在无色灯焰上灼烧,现象为
(2)量气管D、E中应加的液体是
(3)实验中,B瓶壁发热.B中反应结束后,读取量气管中气体体积时,正确的操作为
(4)读取D中气体体积时,B、C中仍有少量产物气体,是否影响应该测得的气体体积
(5)若在D中得到气体448mL(已换算为标况),该气体有刺激性气味、能够使湿润的红色石蕊试纸变蓝,则4.84g固体M中的成分(填化学式)及其质量为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)依据钙元素焰色反应是砖红色分析,导气管连接A和B可以是分液漏斗上下气压相同,便于分液漏斗中的水顺利滴下来;C中是碱石灰用来干燥氨气;
(2)量气管D、E中应加的液体营是和氨气不反应,不能溶解氨气的试剂;
(3)结合读取量气管中气体体积的注意问题和正确的存在方法回答问题,冷至室温,D和E中液面相平,平视读数;
(4)因为在反应前B、C中就有空气,故这时若B、C有少量气体时不会影响;
(5)空气的主要成分是N2、O2,Ca在空气中燃烧产物只可能生成是的CaO和Ca3N2一种或两种.白色固体M与水反应放出有刺激性气味、能够使湿润的红色石蕊试纸变蓝的气体是氨气,所以一定含Ca3N2,利用N守恒可求其质量,然后根据与白色固体M的质量差就可确定有无CaO及它的质量的多少.
(2)量气管D、E中应加的液体营是和氨气不反应,不能溶解氨气的试剂;
(3)结合读取量气管中气体体积的注意问题和正确的存在方法回答问题,冷至室温,D和E中液面相平,平视读数;
(4)因为在反应前B、C中就有空气,故这时若B、C有少量气体时不会影响;
(5)空气的主要成分是N2、O2,Ca在空气中燃烧产物只可能生成是的CaO和Ca3N2一种或两种.白色固体M与水反应放出有刺激性气味、能够使湿润的红色石蕊试纸变蓝的气体是氨气,所以一定含Ca3N2,利用N守恒可求其质量,然后根据与白色固体M的质量差就可确定有无CaO及它的质量的多少.
解答:
解:(1)钙元素焰色反应是砖红色,火焰呈砖红色,导气管连接A和B可以是分液漏斗上下气压相同,便于分液漏斗中的水顺利滴下来,以提高氨气体积的测量准确度;C中所加碱石灰目的是干燥氨气但又不消耗氨气;
故答案为:火焰呈砖红色;便于分液漏斗中的水顺利滴下来,提高氨气体积的测量精度,碱石灰;
(2)量气管D、E中应加的液体营是和氨气不反应,不能溶解氨气的试剂,量气管D、E中应加的四氯化碳,因为氨气能溶解在另外三种液体就不能准确量取气体体积了;
故答案为:B;
(3)量气管中气体体积正确的操作是冷至室温、D和E中液面相平、,平视读数;
故答案为:冷至室温,D和E中液面相平,平视读数;
(4)因为在反应前B、C中就有空气,故这时若B、C有少量气体时不会影响应该测得的气体体积;
故答案为:不影响;
(5)空气的主要成分是N2、O2,Ca在空气中燃烧产物只可能生成是的CaO和Ca3N2一种或两种.白色固体M与水反应放出有刺激性气味、能够使湿润的红色石蕊试纸变蓝的气体是氨气,所以一定含Ca3N2,利用N守恒可求其质量,448mL氨气物质的量=
=0.02mol,Ca3N2的质量=0.01mol×148g/mol=1.48g,然后根据与白色固体M的质量差就可确定,4.84g-1.48g=3.36g,判断存在CaO;4.84g固体M中的成分(填化学式)及其质量为1.48gCa3N2和3.36gCaO,
故答案为:1.48gCa3N2和3.36gCaO.
故答案为:火焰呈砖红色;便于分液漏斗中的水顺利滴下来,提高氨气体积的测量精度,碱石灰;
(2)量气管D、E中应加的液体营是和氨气不反应,不能溶解氨气的试剂,量气管D、E中应加的四氯化碳,因为氨气能溶解在另外三种液体就不能准确量取气体体积了;
故答案为:B;
(3)量气管中气体体积正确的操作是冷至室温、D和E中液面相平、,平视读数;
故答案为:冷至室温,D和E中液面相平,平视读数;
(4)因为在反应前B、C中就有空气,故这时若B、C有少量气体时不会影响应该测得的气体体积;
故答案为:不影响;
(5)空气的主要成分是N2、O2,Ca在空气中燃烧产物只可能生成是的CaO和Ca3N2一种或两种.白色固体M与水反应放出有刺激性气味、能够使湿润的红色石蕊试纸变蓝的气体是氨气,所以一定含Ca3N2,利用N守恒可求其质量,448mL氨气物质的量=
| 0.448L |
| 22.4L/mol |
故答案为:1.48gCa3N2和3.36gCaO.
点评:本题考查金属钙、氨气的性质以及量气体体积应该注意的问题等知识,掌握实验基本操作和步骤连接应用时胶体关键,题目难度中等.

练习册系列答案
相关题目
把0.05mol NaOH固体分别加入下列100mL液体中,溶液导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol/L盐酸 |
| C、0.5mol/LCH3COOH |
| D、0.5mol/LNH4Cl溶液 |
下列化学用语的表示,不正确的是( )
A、NaCl的电子式: |
B、Mg原子结构示意图: |
| C、乙烯的结构简式:CH2=CH2 |
D、甲烷的结构式: |
下列实验操作与安全事故处理正确的是( )
| A、金属钠着火时可用干粉灭火器扑灭 |
| B、在硫酸铜晶体结晶水含量测定的实验中,称量操作至少需要四次 |
| C、铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体 |
| D、在250 mL烧杯中加入216 mL水和24 g NaOH固体,配制10%NaOH溶液 |