题目内容
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Mn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为
(2)调节pH时不用氢氧化钠原因是:
(3)加入MnS的目的是除去
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为
分析:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)加入MnS后,因为酸性条件下CuS、ZnS更难溶所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应,据此写出MnO2参与的电极反应方程式为;从工艺流程是否简单、反应产物是否产生污染物等方面进行分析.
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)加入MnS后,因为酸性条件下CuS、ZnS更难溶所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应,据此写出MnO2参与的电极反应方程式为;从工艺流程是否简单、反应产物是否产生污染物等方面进行分析.
解答:解:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O,
故答案为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,若使用氢氧化钠溶液,会使铝离子反应生成偏铝酸根离子,无法生成沉淀,锰离子与氢氧根离子反应生成氢氧化锰沉淀;铝离子完全沉淀时溶液的pH=5.2,铁离子完全沉淀时溶液pH=3.2,所以调节溶液的最小pH为5.2;结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为Fe(OH)3和Al(OH)3,
故答案为:氢氧化钠会使氢氧化铝溶解、使锰离子沉淀;5.2;Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为MnO2+H2O+e-=MnOOH+OH-;根据反应方程式可知,该方法的优点为:工艺流程简单;生成二氧化碳和水不影响硫酸锰的纯度;反应过程中无有毒物质生成,不会造成二次污染等,
故答案为:MnO2+H2O+e-=MnOOH+OH-;工艺流程简单;生成二氧化碳和水不影响硫酸锰的纯度;反应过程中无有毒物质生成,不会造成二次污染等.
故答案为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,若使用氢氧化钠溶液,会使铝离子反应生成偏铝酸根离子,无法生成沉淀,锰离子与氢氧根离子反应生成氢氧化锰沉淀;铝离子完全沉淀时溶液的pH=5.2,铁离子完全沉淀时溶液pH=3.2,所以调节溶液的最小pH为5.2;结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为Fe(OH)3和Al(OH)3,
故答案为:氢氧化钠会使氢氧化铝溶解、使锰离子沉淀;5.2;Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为MnO2+H2O+e-=MnOOH+OH-;根据反应方程式可知,该方法的优点为:工艺流程简单;生成二氧化碳和水不影响硫酸锰的纯度;反应过程中无有毒物质生成,不会造成二次污染等,
故答案为:MnO2+H2O+e-=MnOOH+OH-;工艺流程简单;生成二氧化碳和水不影响硫酸锰的纯度;反应过程中无有毒物质生成,不会造成二次污染等.
点评:本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

练习册系列答案
相关题目
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4?H2O的流程如下:
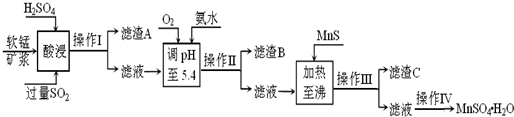
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、Al、Zn、Cu等.25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 .酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 .

(2)滤渣B的主要成分是 .
(3)加入MnS的目的是 .
(4)操作IV的步骤为 、 、过滤、洗涤、干燥.
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: .
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程).

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、Al、Zn、Cu等.25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为

(2)滤渣B的主要成分是
(3)加入MnS的目的是
(4)操作IV的步骤为
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为:
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为
(07年广东化学·24)(10分)

二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。

