题目内容
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4?H2O的流程如下: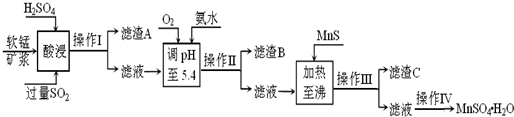
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、Al、Zn、Cu等.25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为

(2)滤渣B的主要成分是
(3)加入MnS的目的是
(4)操作IV的步骤为
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为:
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为
分析:(1)根据酸浸时SO2将MnO2还原为MnSO4,根据元素守恒写出离子方程式;根据图1和图2分析判断;
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断.
(3)根据工艺流程及硫化物的Ksp判断.
(4)根据从溶液中分离溶质的操作分析;
(5)Mn2+在阳极失去电子生成MnO2;
(6)根据表中数据,利用Ksp=c(Zn2+).c2(OH-)计算.
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断.
(3)根据工艺流程及硫化物的Ksp判断.
(4)根据从溶液中分离溶质的操作分析;
(5)Mn2+在阳极失去电子生成MnO2;
(6)根据表中数据,利用Ksp=c(Zn2+).c2(OH-)计算.
解答:解:(1)根据酸浸时SO2将MnO2还原为MnSO4,所以其反应离子方程式为MnO2+SO2=Mn2++SO42-;根据图1可知pH为3左右SO2的吸收率高,根据图2可知温度为40℃左右SO2的吸收率高;
故答案为:MnO2+SO2=Mn2++SO42-;pH为3左右、温度为40℃左右;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3;
故答案为:Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
故答案为:Cu2+、Zn2+;
(4)从溶液中分离溶质,要先蒸发浓缩,然后冷却结晶,然后过滤、洗涤、干燥,
故答案为:蒸发浓缩,冷却结晶;
(5)Mn2+在阳极失去电子生成MnO2,其电极反应式应为Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)当溶液的pH=8.0时,Zn2+完全沉淀,溶液中c(Zn2+)≈10-5mol?L-1,Ksp=c(Zn2+).c2(OH-)=10-5?(10-6)2=1.0×10-17,
故答案为:1.0×10-17.
故答案为:MnO2+SO2=Mn2++SO42-;pH为3左右、温度为40℃左右;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3;
故答案为:Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
故答案为:Cu2+、Zn2+;
(4)从溶液中分离溶质,要先蒸发浓缩,然后冷却结晶,然后过滤、洗涤、干燥,
故答案为:蒸发浓缩,冷却结晶;
(5)Mn2+在阳极失去电子生成MnO2,其电极反应式应为Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)当溶液的pH=8.0时,Zn2+完全沉淀,溶液中c(Zn2+)≈10-5mol?L-1,Ksp=c(Zn2+).c2(OH-)=10-5?(10-6)2=1.0×10-17,
故答案为:1.0×10-17.
点评:本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 .
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 .
(3)加入MnS的目的是除去 杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 .回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,该方法的优点是 .

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Mn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为
(2)调节pH时不用氢氧化钠原因是:
(3)加入MnS的目的是除去
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为
(07年广东化学·24)(10分)

二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。

