题目内容
13.工业上金属的冶炼过程复杂.(1)炼铁涉及的2个热化学方程式:
Fe2O2(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ.mol-1
Fe3O4(s)+CO(g)═2FeO(s)+CO2(g)△H=+640.4kJ.mol-1
则反应Fe3O4(s)+CO(g)═2FeO(s)+CO2(g)的△H=+411.20kJ/mol.
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出电解总方程式2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+O2↑+2H2SO4.
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力.镀锌钢板的镀层一旦被破坏后,锌将作为原电池的电极发生氧化反应.(填“氧化”或“还原”)
分析 (1)利用盖斯定律分析;
(2)电解硫酸锌溶液时,阳极上氢氧根离子放电,阴极上锌离子放电;
(3)锌、铁和电解质溶液构成的原电池中,较活泼的金属作负极,负极上失电子发生氧化反应;
解答 解:(1)①Fe2O2(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ.mol-1;②Fe3O4(s)+CO(g)═2FeO(s)+CO2(g)△H=+640.4kJ.mol-1
将方程式①+$\frac{2}{3}$×②得Fe2O3(s)+CO(g)=2FeO(s)+CO2(g)△H=-15.73kJ/mol+$\frac{2}{3}$(+640.4kJ/mol )=+411.20kJ/mol;
故答案为:+411.20kJ/mol;
(2)电解硫酸锌溶液时,阳极上氢氧根离子放电生成氧气,阴极上锌离子放电生成锌,电解反应方程式为:2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+O2↑+2H2SO4,
故答案为:2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+O2↑+2H2SO4;
(3)锌、铁和电解质溶液构成的原电池中,锌易失电子发生氧化反应而作负极,故答案为:氧化.
点评 本题考查盖斯定律、电解原理、原电池原理等知识点,难度不大,会判断原电池正负极、离子放电顺序,难度不大.

练习册系列答案
相关题目
4.下列说法错误的是( )
①乙二酸俗称草酸 ②电石是纯净物 ③冰醋酸是混合物
④75%(体积分数)的乙醇溶液常用于医疗消毒
⑤氟氯代烷(商品名氟利昂)常用作制冷剂、灭火剂、溶剂等
⑥汽车用丙三醇作防冻液 ⑦蛋白质的变性和盐析都是不可逆过程.
①乙二酸俗称草酸 ②电石是纯净物 ③冰醋酸是混合物
④75%(体积分数)的乙醇溶液常用于医疗消毒
⑤氟氯代烷(商品名氟利昂)常用作制冷剂、灭火剂、溶剂等
⑥汽车用丙三醇作防冻液 ⑦蛋白质的变性和盐析都是不可逆过程.
| A. | ②③⑥⑦ | B. | ①②④⑦ | C. | ②③④⑥ | D. | ②③⑤⑦ |
1.下列有关实验说法正确的是( )
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 用标准NaOH溶液测定食醋总酸含量时应该使用甲基橙作为指示剂 | |
| C. | 硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物 | |
| D. | 将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,检验火柴头中是否含有氯元素 |
18.氯化硼的熔点为10.7℃,在氯化硼分子中,Cl-B-Cl键角为120℃,它可以水解,水解产物之一是硼酸(H3BO3).下列有磁氯化硼的叙述正确的是( )
| A. | 氯化硼是原子晶体 | B. | 熔化时,氯化硼能导电 | ||
| C. | 氯化硼分子是一种非极性分子 | D. | 氯化硼水解得到两种弱酸 |
3.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第VIIA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为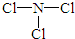 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为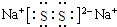 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
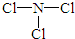 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
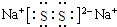 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
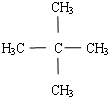 .
. 某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求
某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求
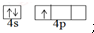 .
.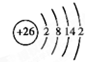
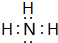 ,含有共价键化学键,E的电子表达式是
,含有共价键化学键,E的电子表达式是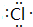 .
.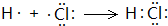 .
.


