题目内容
(13分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
(1)2H++2e-=H2↑ 还原 锌 铜 正极
(2)Cu、正、 Cu-2e-=Cu2+ 2Fe3+ +2e- = 2Fe2+
解析试题分析:(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中形成原电池,该原电池中锌是负极,发生氧化反应,铜是正极,溶液中的氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑;外电路上,电子从负极沿导线到正极,即电子是从锌经外电路到铜;溶液中H+ 向正极移动。(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,铜的化合价由0价升高为+2价,发生氧化反应,作原电池的负极,电极反应式为Cu-2e-=Cu2+;电解质溶液中阳离子Fe3+向正极迁移,在正极上发生还原反应,电极反应式为2Fe3+ +2e- = 2Fe2+。
考点:考查原电池原理、电极方程式书写。

下图为铜锌原电池示意图,下列说法正确的是
| A.电子由铜片通过导线流向锌片 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.锌片逐渐溶解 |
| D.该装置能将电能转变为化学能 |
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
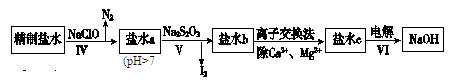
①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。

⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应的离子方程式为□VO2+ +□H2C2O4+□_____=□VO2++□CO2↑+□H2O,试将其配平。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ +V2++2H+
 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。 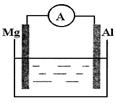


 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
