题目内容
有一瓶100ml硫酸和硝酸的混合溶液,取出10.00ml该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,得4.66g沉淀.滤液跟2.00mol/L的NaOH溶液反应共用去35.00mlNaOH溶液时恰好使溶液呈中性,则混合酸中硫酸和硝酸的物质的量的浓度是多少?
考点:有关混合物反应的计算
专题:计算题
分析:4.66g沉淀是硫酸钡的质量,根据n=
计算硫酸钡的物质的量,根据硫酸根守恒计算10mL混合酸液中n(H2SO4),再根据c=
计算硫酸的物质的量浓度;
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,根据n=cV计算消耗的氢氧化钠的物质的量,进而计算10mL原混合酸液中n(H+),原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),据此计算原10mL溶液中n(HNO3),再根据c=
计算硝酸的物质的量浓度.
| m |
| M |
| n |
| V |
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,根据n=cV计算消耗的氢氧化钠的物质的量,进而计算10mL原混合酸液中n(H+),原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),据此计算原10mL溶液中n(HNO3),再根据c=
| n |
| V |
解答:
解:4.66g沉淀是硫酸钡的质量,硫酸钡的物质的量为
=0.02mol,根据硫酸根守恒可知,混合酸液中n(H2SO4)=n(BaSO4)=0.02mol,混合酸液中硫酸的物质的量浓度为
=2mol/L;
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,消耗的氢氧化钠的物质的量为0.035L×2mol/L=0.07mol,故10mL原混合酸液中n(H+)=n(NaOH)=0.07mol,原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),故n(HNO3)=0.07mol-2×0.02mol=0.03mol,故原混合酸液中硝酸的物质的量浓度为
=3mol/L;
答:原混合酸液中H2SO4的物质的量浓度为2mol/L,HNO3的物质的量浓度为3mol/L;
| 4.66g |
| 233g/mol |
| 0.02mol |
| 0.01L |
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,消耗的氢氧化钠的物质的量为0.035L×2mol/L=0.07mol,故10mL原混合酸液中n(H+)=n(NaOH)=0.07mol,原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),故n(HNO3)=0.07mol-2×0.02mol=0.03mol,故原混合酸液中硝酸的物质的量浓度为
| 0.03mol |
| 0.01L |
答:原混合酸液中H2SO4的物质的量浓度为2mol/L,HNO3的物质的量浓度为3mol/L;
点评:本题考查混合物的有关计算,难度中等,清楚发生的反应是关键,注意根据守恒法解答.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
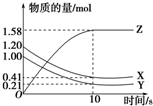 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、达平衡时Y的物质的量分数为:9.5% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
不用其它试剂鉴别:①Ba(OH)2②KCl ③Al(NO3)3④Fe2(SO4)3等四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确操作顺序是( )
| A、④②①③ | B、①④③② |
| C、①③④② | D、④①③② |
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比可能为( )
| A、3:2 | B、2:1 |
| C、9:2 | D、8:1 |
关于电解氯化钠溶液,下列叙述正确的是( )
| A、电解时在阳极得到氯气,在阴极得到金属钠 |
| B、在阳极附近有黄绿色的气体产生 |
| C、在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D、电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(OH-)>c(HF) |
| D、c(HF)>c(F-) |
