题目内容
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
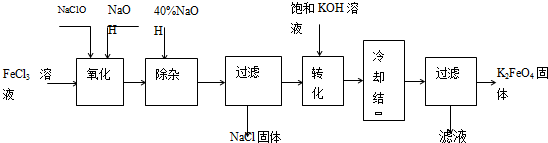
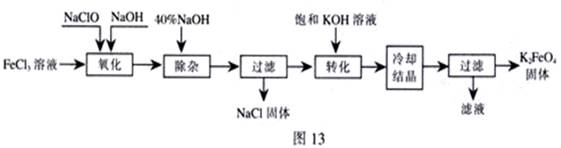
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。

(1)写出“氧化”过程中反应的离子方程式:___________________________。
(2)写出“转化”过程中发生反应的化学方程式为_______________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用__________溶解,然后____________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为_________________________。
(2)写出“转化”过程中发生反应的化学方程式为_______________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用__________溶解,然后____________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为_________________________。
(1)2Fe3++10OH-+3ClO-==2FeO42-+3Cl-+5H2O
(2)Na2FeO4+2KOH=K2FeO4+2NaOH
(3)稀KOH溶液;加入饱和KOH溶液,冷却结晶
(4)Fe+8OH--6e-= FeO42-+4H2O
(2)Na2FeO4+2KOH=K2FeO4+2NaOH
(3)稀KOH溶液;加入饱和KOH溶液,冷却结晶
(4)Fe+8OH--6e-= FeO42-+4H2O

练习册系列答案
相关题目
新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
| A、反应①为氧化还原反应,反应②为复分解反应 | B、反应①中氧化产物与还原产物物质的量之比为2:9 | C、反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |