题目内容
化学需氧量(COD)常作为衡量水体中有机物含量多少的指标.某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:

已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是 .
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是 .用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是 .
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL.根据以上实验数据计算海水试样的COD(用每升水样相当于消耗多少毫克O2表示,单位:mg?L-1)(写出计算过程).

已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL.根据以上实验数据计算海水试样的COD(用每升水样相当于消耗多少毫克O2表示,单位:mg?L-1)(写出计算过程).
考点:中和滴定
专题:
分析:(1)在酸性条件下,海水中氯离子能被高锰酸根离子氧化生成氯气;
(2)根据碘易升华;根据淀粉遇碘变蓝色,达到滴定终点蓝色褪色,
(3)根据反应10I-+2MnO4-+16H+=5I2+2Mn2++8H2O、2S2O32-+I2=2I-+S4O62-,关系式为:2MnO4-~5I2~10Na2S2O3,先求出水样中氧化碘离子的高锰酸钾,再求出氧化水中还原性物质的高锰酸钾,根据电子守恒求出试样的COD.
(2)根据碘易升华;根据淀粉遇碘变蓝色,达到滴定终点蓝色褪色,
(3)根据反应10I-+2MnO4-+16H+=5I2+2Mn2++8H2O、2S2O32-+I2=2I-+S4O62-,关系式为:2MnO4-~5I2~10Na2S2O3,先求出水样中氧化碘离子的高锰酸钾,再求出氧化水中还原性物质的高锰酸钾,根据电子守恒求出试样的COD.
解答:
解:(1)在酸性条件下,海水中氯离子能被高锰酸根离子氧化生成氯气,而在碱性条件下不能将氯离子氧化;
故答案为:海水中含有氯离子,氯离子能被高锰酸根离子氧化生成氯气;根据滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝,判断达到终点时溶液颜色变化;
(2)碘易升华,一旦受热,见光易挥发;溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:防止生成的单质碘受热,见光易挥发;当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(3)n(Na2S2O3)=0.0100mol?L-1×10.00×10-3L=1.000×10-4mol,
关系式为:2MnO4-~5I2~10Na2S2O3,
2 10
n(MnO4-) 1.000×10-4mol
n(MnO4-)=
n(I2)=2.000×10-5mol
则氧化水样中的还原性物质消耗的n(KMnO4)=0.1000mol?L-1×10.00mL×10-3L-2.000×10-5mol=9.800×10-4mol;
由于KMnO4氧化海水中还原性物质时,MnO4-还原为MnO2,根据电子守恒,相当于n(O2)的物质的量为:4×n(O2)=3×9.800×10-4mol,n(O2)=7.350×10-4mol;
m(O2)=32g?mol-1×7.350×10-4mol=2.352×10-2g=23.52mg,COD=23.52mg/0.1L=235.2mg?L-1;
故答案为:235.2mg?L-1;
故答案为:海水中含有氯离子,氯离子能被高锰酸根离子氧化生成氯气;根据滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝,判断达到终点时溶液颜色变化;
(2)碘易升华,一旦受热,见光易挥发;溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:防止生成的单质碘受热,见光易挥发;当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(3)n(Na2S2O3)=0.0100mol?L-1×10.00×10-3L=1.000×10-4mol,
关系式为:2MnO4-~5I2~10Na2S2O3,
2 10
n(MnO4-) 1.000×10-4mol
n(MnO4-)=
| 1 |
| 5 |
则氧化水样中的还原性物质消耗的n(KMnO4)=0.1000mol?L-1×10.00mL×10-3L-2.000×10-5mol=9.800×10-4mol;
由于KMnO4氧化海水中还原性物质时,MnO4-还原为MnO2,根据电子守恒,相当于n(O2)的物质的量为:4×n(O2)=3×9.800×10-4mol,n(O2)=7.350×10-4mol;
m(O2)=32g?mol-1×7.350×10-4mol=2.352×10-2g=23.52mg,COD=23.52mg/0.1L=235.2mg?L-1;
故答案为:235.2mg?L-1;
点评:本题考查了水样中氧气含量的测定,涉及的内容较多,本题难度较大,需要分析实验原理并联系滴定知识合理完成,充分考查了学生的分析、理解能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)═2H2O(l)△H1=-Q1 kJ?mol-1
(2)2H2(g)+O2(g)═2H2O(l)△H1=-Q2 kJ?mol-1
(3)2H2(l)+O2(g)═2H2O(g)△H1=-Q3 kJ?mol-1
则Q1、Q2、Q3的关系表示正确的是( )
(1)2H2(l)+O2(g)═2H2O(l)△H1=-Q1 kJ?mol-1
(2)2H2(g)+O2(g)═2H2O(l)△H1=-Q2 kJ?mol-1
(3)2H2(l)+O2(g)═2H2O(g)△H1=-Q3 kJ?mol-1
则Q1、Q2、Q3的关系表示正确的是( )
| A、Q1=Q2<Q3 |
| B、Q2>Q1>Q3 |
| C、Q3>Q2>Q1 |
| D、Q1=Q2=Q3 |
下列物质所含的化学键只有离子键的是( )
| A、H2O2 |
| B、CaF2 |
| C、KOH |
| D、Cl2 |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、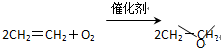 |
D、 |
下列各物质中酸性最弱的是( )
| A、H2CO3 |
| B、H3PO4 |
| C、H2SO4 |
| D、H3SiO3 |
下列说法中正确的是( )
| A、构成分子晶体的微粒一定含有共价键 |
| B、完全由非金属元素组成的化合物不一定是共价化合物 |
| C、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |