题目内容
5.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)?CH30H(g)△H,下表是该反应在不同温度下的化学平衡常数(K):| 温度/℃ | 250 | 310 | 350 |
| K/(mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol•L-1 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是a(填序号).
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳.该电池的负极反应式为:CH3OH+H2O=CO2+6H++6e-.若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为67.2 L.
分析 (1)升高温度,平衡向吸热反应方向移动,升高温度平衡常数减小,平衡向逆反应方向移动,则正反应是放热反应;
(2)平衡时,c(CO)=0.5mol•L-1,则平衡时n(CO)=0.5mol/L×2L=1mol,则参加反应的n(CO)=(2-1)mol=1mol,根据方程式知,参加反应的n(H2)=2n(CO)=2mol,生成n(CH30H)=n(CO)=1mol,平衡时c(H2)=$\frac{6-2}{2}$mol/L=2mol/L、c(CH30H)=$\frac{1mol}{2L}$=0.5mol/L,浓度商=$\frac{0.5}{0.5×{2}^{2}}$=0.25,根据化学平衡常数确定温度;
(3)①2-4min内v(CO)=$\frac{0.6-0.3}{4-2}$ mol•L-1 min-1=0.15 mol•L-1 min-1,再根据同一反应中同一时间段内各物质的反应速率之比等于计量数之比计算氢气反应速率;
②反应达到平衡状态时,CO转化率=$\frac{0.8-0.3}{0.8}$×100%;
③0-2min内,CO物质的量浓度减少(0.8-0.6)mol/L=0.2mol/L、2-4min内CO物质的量浓度减少(0.6-0.3)mol/L=0.3mol/L,相同时间内随着反应的进行,CO的反应速率增大,改变的条件可能是温度、催化剂或CO浓度;
(4)将方程式$\frac{①-②}{2}+2③$得CH3OH(l)+O2(g)=CO(g)+2H2O(l),焓变进行相应的改变;
(5)甲醇燃料酸性电池中,负极上甲醇失电子和水反应生成二氧化碳和氢离子;根据转移电子相等计算生成氢气体积.
解答 解:(1)升高温度,平衡向吸热反应方向移动,升高温度平衡常数减小,平衡向逆反应方向移动,则正反应是放热反应,△H<0,故答案为:<;
(2)平衡时,c(CO)=0.5mol•L-1,则平衡时n(CO)=0.5mol/L×2L=1mol,则参加反应的n(CO)=(2-1)mol=1mol,根据方程式知,参加反应的n(H2)=2n(CO)=2mol,生成n(CH30H)=n(CO)=1mol,平衡时c(H2)=$\frac{6-2}{2}$mol/L=2mol/L、c(CH30H)=$\frac{1mol}{2L}$=0.5mol/L,浓度商=$\frac{0.5}{0.5×{2}^{2}}$=0.25,根据表中数据知,该温度是310℃,故答案为:310;
(3)①2-4min内v(CO)=$\frac{0.6-0.3}{4-2}$ mol•L-1 min-1=0.15 mol•L-1 min-1,再根据同一反应中同一时间段内各物质的反应速率之比等于计量数之比计算氢气反应速率为0.3mol•L-1 min-1,故答案为:0.3mol•L-1 min-1;
②反应达到平衡状态时,CO转化率=$\frac{0.8-0.3}{0.8}$×100%=62.5%,故答案为:62.5%;
③0-2min内,CO物质的量浓度减少(0.8-0.6)mol/L=0.2mol/L、2-4min内CO物质的量浓度减少(0.6-0.3)mol/L=0.3mol/L,相同时间内随着反应的进行,CO的反应速率增大,改变的条件可能是温度、催化剂或CO浓度,故选a;
(4)将方程式$\frac{①-②}{2}+2③$得CH3OH(l)+O2(g)=CO(g)+2H2O(l),△H=$\frac{-1275.6-(-566.0)}{2}kJ/mol+2(-44.0kJ/mol)$=-442.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)甲醇燃料酸性电池中,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O=CO2+6H++6e-;32g甲醇的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol甲醇反应失去6mol电子,
根据转移电子相等计算生成氢气体积=$\frac{6mol}{2}×22.4L/mol$=67.2L.
故答案为:CH3OH+H2O=CO2+6H++6e-;67.2.
点评 本题考查化学平衡有关计算、原电池原理、化学平衡影响因素等知识点,为高频考点,明确平衡影响因素原理、原电池原理是解本题关键,难点是电极反应式的书写,注意结合溶液酸碱性书写,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”、“非极性”)键形成的.
,该化合物是由极性(填“极性”、“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O═HClO+HCl.
| A. | NO2或N2O4的浓度不再变化 | B. | c(NO2)=c(N2O4) | ||
| C. | v正(NO2)=v逆(N2O4) | D. | NO2、N2O4的总质量不再变化 |
| A. | Cl-的结构示意图: | |
| B. | 硝基苯的结构简式: | |
| C. | 乙烯的结构式: | |
| D. | 氢元素有三种核素:${\;}_{1}^{1}H$、${\;}_{1}^{2}$D、${\;}_{1}^{3}$T |
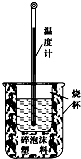 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
 +(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$
+(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$ +HCl.
+HCl.

