题目内容
1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x 值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
⑴通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< .
⑵某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称).
⑶经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键.试推断AlBr3中化学键类型是 .
⑷预测周期表中,x 值最小的元素位于 周期 族.(放射性元素除外)
【解析】(每空1分,共8分)(1)2.55 3.44 0.93 1.57
(2) 氮 (3)共价键 (4) 6,IA
试题分析:(1)非金属性越强,电负性越大。则根据表中数据可知,氮元素的电负性应该对于碳元素和P元素的电负性,但小于氧元素的电负性,即2.55<x (N)<3.44;镁元素的电负性对于钠元素的电负性而小于铝元素和Be元素的电负性,即0.93<x (Mg)<1.57。
(2)N所以的电负性强于S元素的电负性,所以如果某有机化合物结构中含S-N键,则其共用电子对偏向氮元素。
(3)溴元素的电负性小于氯原子的电负性,而氯元素的电负性是3.16。由于3.16-1.61<1.7,所以该化合物形成的化学键是共价键。
(4)金属性越强,电负性越小。金属性最强的是第六周期第IA族的Cs元素。
考点:考查电负性强弱比较、计算以及电负性的有关应用和判断
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和晶体方法的指导。该题难易适中,贴近高考,有利于培养学生的逻辑推理能力和发散思维能力,也有利于培养学生的自学能力和知识的迁移能力。

元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,完成下列有关问题:
(1)预测周期表中电负性最大的元素应为______;估计钙元素的电负性的取值范围:__________<X<__________。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_______________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系________________________________________。?
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为__________,其理由是__________。
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是 ; 简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。
(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
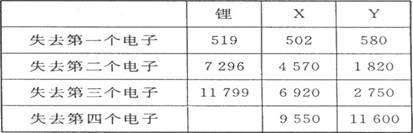
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5] |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成 的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
______________,其理由是 。