题目内容
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
X在周期表中位置:第
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
①上表中电负性最小的元素是
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为
由表中数据可知,X的第一电离能与Li形成不大,性质相似,根据对角线规则,可知X为Mg;
由表中数据可知,Y的第四电离能剧增,表现+3价;
(2)①由表中数据可知,电负性最小的元素是K;
由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性增大,根据K与Mg的电负性推断;
②Br的电负性小于Cl,Cl和Al的电负性差值为1.5,Br和Al的电负性差值为1.5,AlBr3中化学键为共价键.
由表中数据可知,X的第一电离能与Li形成不大,性质相似,根据对角线规则,可知X为Mg,处于第三周期第ⅡA;
由表中数据可知,Y的第四电离能剧增,表现+3价;
故答案为:Li原子失去一个电子后,Li+已经形成了稳定结构,此时再失去电子很困难;三;ⅡA;+3;
(2)①由表中数据可知,电负性最小的元素是K;
由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性增大,故Ca的电负性介于K与Mg的电负性之间,即0.8<X<1.2;
故答案为:K;0.8;1.2;
②Br的电负性小于Cl,Cl和Al的电负性差值为1.5,Br和Al的电负性差值为1.5,小于1.7,AlBr3中化学键为共价键;
故答案为:共价键;AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):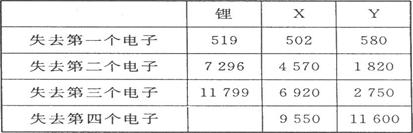
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
______________,其理由是 。
(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
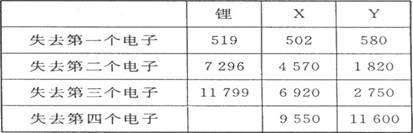
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5] |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成 的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
______________,其理由是 。
(9分)、(1)下表是部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3[ |
+2 |
+6、-2 |
-2 |
①L元素的名称是______,R元素的名称是______。
②能与T元素组成的化合物具有两性的是________________(写化学式)。
(2)某种融雪剂主要成分为XY2,X、Y均为周期表中前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
①该融雪剂主要成分的化学式为__________;X与氢元素形成的化合物的电子式为____________________。
②元素D、E原子的最外层电子数是相应原子电子层数的2倍,D与Y相邻,D元素是______,E元素是______。
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):

通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)
也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1. 0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负
性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成
的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是 。