题目内容
18.已知H2和O2反应放热,且破坏1mol H-H键、1mol O=O键,需吸收的能量分别为Q1 kJ、Q2kJ,形成1mol O-H键需释放Q3kJ.下列关系正确的是( )| A. | Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
分析 氢气在氧气中燃烧的反应放热反应,△H<0,根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,据此进行解答.
解答 解:破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,
破坏1molO=O键消耗的能量为Q2kJ,则O=O键键能为Q2kJ/mol,
形成1molH-O键释放的能量为Q3kJ,则H-O键能为Q3kJ/mol,
对于2H2(g)+O2(g)═2H2O,反应热△H=反应物的总键能-生成物的总键能,则:
反应热△H=2Q1kJ/mol+Q2kJ/mol-4Q3kJ/mol=(2Q1+Q2-4Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,则(2Q1+Q2-4Q3)<0,
即:2Q1+Q2<4Q3,
故选C.
点评 本题考查反应热的计算,题目难度不大,明确从键能的角度计算反应热的方法为解答关键,注意掌握化学反应与能力变化的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
9.在一定温度下,在恒压的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
6.下列说法正确的是( )
| A. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 | |
| D. | 非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键 |
3.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法不正确的是( )
| A. | 蒸馏常用于分离提纯液态有机混合物,温度计的水银球应位于支管口附近 | |
| B. | 核磁共振氢谱通常用于分析有机物的相对分子质量 | |
| C. | 燃烧法通常是研究和确定有机物成分的有效方法之一 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
7.把元素周期表中第16号元素和第6号元素的原子相比较,下列数据中前者是后者的4倍的是( )
| A. | 电子数 | B. | 最外层电子数 | C. | 中子数 | D. | 次外层电子数 |
8.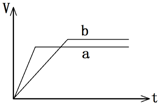 某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
 某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )| A. | 向试管中滴加少许硫酸铜溶液 | B. | 在反应过程中对试管加热 | ||
| C. | 用铁粉代替铁片 | D. | 用98%的浓硫酸代替稀硫酸 |
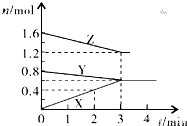 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
 .
. .
.