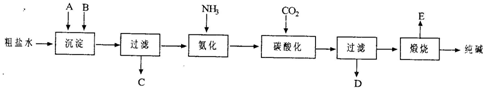
题目内容
(1)500mL的盐酸与足量的Zn反应,放出H25.6L(标况下),则盐酸的物质的量浓度为______mol/L.
(2)Na、Mg、Al与足量的盐酸反应生成等质量的H2,则消耗这三种金属的物质的量之比为______.
解:(1)5.6L标准态下H2 的物质的量为0.25 mol,由化学方程:Zn+2HCl=ZnCl2+H2↑,可知0.25molH2需要0.5molHCl被置换,0.5mol HCl其体积为500ml,
故盐酸的物质的量浓度是c= =
=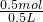 =1.0mol/L,故答案为:1.0;
=1.0mol/L,故答案为:1.0;
(2)因Na、Mg、Al与足量的盐酸反应生成等质量的H2,由关系式:2Na~H2,Mg~H2,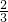 Al~H2,得三种金属的物质的量之比为:2:1:
Al~H2,得三种金属的物质的量之比为:2:1: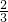 ,故答案为:6:3:2.
,故答案为:6:3:2.
分析:(2)根据氢气的体积利用方程式求出盐酸的物质的量,代入公式c= ,求出盐酸的浓度;
,求出盐酸的浓度;
(2)根据三种金属的化合价可得与盐酸反应的关系式分别为:2Na~H2,Mg~H2,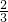 Al~H2,根据反应的方程式计算.
Al~H2,根据反应的方程式计算.
点评:本题考查化学方程式的计算,题目难度不大,注意根据化学方程式判断有关反应的量的关系.
故盐酸的物质的量浓度是c=
 =
=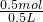 =1.0mol/L,故答案为:1.0;
=1.0mol/L,故答案为:1.0;(2)因Na、Mg、Al与足量的盐酸反应生成等质量的H2,由关系式:2Na~H2,Mg~H2,
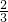 Al~H2,得三种金属的物质的量之比为:2:1:
Al~H2,得三种金属的物质的量之比为:2:1: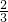 ,故答案为:6:3:2.
,故答案为:6:3:2.分析:(2)根据氢气的体积利用方程式求出盐酸的物质的量,代入公式c=
 ,求出盐酸的浓度;
,求出盐酸的浓度;(2)根据三种金属的化合价可得与盐酸反应的关系式分别为:2Na~H2,Mg~H2,
 Al~H2,根据反应的方程式计算.
Al~H2,根据反应的方程式计算.点评:本题考查化学方程式的计算,题目难度不大,注意根据化学方程式判断有关反应的量的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
 将质量相等的锌片和铜片用导线相连浸入500mL 硫酸铜溶液中构成如下图的装置.(1)此装置为
将质量相等的锌片和铜片用导线相连浸入500mL 硫酸铜溶液中构成如下图的装置.(1)此装置为