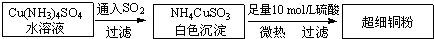题目内容
氯化亚铜(CuCl),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物,它露置于空气中易被氧化为绿色的高价铜盐.氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业.

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
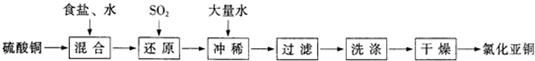
(1)反应①的化学方程式为
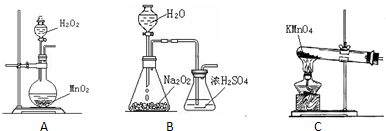
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是
(4)工业化生产时,95%乙醇可通过

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
NH4[CuCl2]=CuCl↓+NH4Cl
NH4[CuCl2]=CuCl↓+NH4Cl
,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分
避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分
.(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
B
B
方案(填字母序号).
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是
氯化铵溶于水吸收大量热量
氯化铵溶于水吸收大量热量
;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色
烧瓶上方红棕色气体逐渐变为无色
时停止通入氧气,打开瓶塞,沿a或c
a或c
(填字母)口倾出棕色反应液于1 000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.(4)工业化生产时,95%乙醇可通过
蒸馏
蒸馏
方法循环利用,而NH4Cl
NH4Cl
、HNO3
HNO3
可直接循环利用.分析:(1)根据工艺流程可知,反应①过滤后,滤饼用酒精洗涤的CuCl,说明反应生成CuCl,还生成氯化铵;
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;
烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用.
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;
烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用.
解答:解:(1)根据工艺流程可知,反应①过滤后,滤饼用酒精洗涤的CuCl,说明反应生成CuCl,还生成氯化铵,反应方程式为:NH4[CuCl2]=CuCl↓+NH4Cl,
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗,
故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制,A、C装置无法判断通入氧气的速率,故选选择B装置,
故答案为:B;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液,
故答案为:氯化铵溶于水吸收大量热量;烧瓶上方红棕色气体逐渐变为无色;a或c;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用,
故答案为:蒸馏;NH4Cl、HNO3.
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗,
故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制,A、C装置无法判断通入氧气的速率,故选选择B装置,
故答案为:B;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液,
故答案为:氯化铵溶于水吸收大量热量;烧瓶上方红棕色气体逐渐变为无色;a或c;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用,
故答案为:蒸馏;NH4Cl、HNO3.
点评:本题考查化学工艺流程、物质的分离提纯、对操作的理解、对装置的评价等,理解工艺流程原理是关键,有利于基础知识的巩固,侧重对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
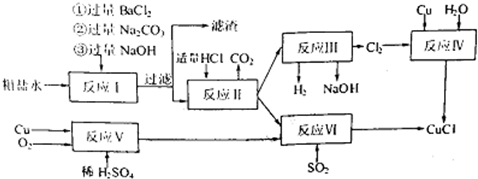
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
Ⅱ、探究实验
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物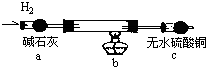
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是 ;
②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;
③写出装置b中发生反应的化学方程式: .
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质.
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物

实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O
②在c装置后将气体通入
③写出装置b中发生反应的化学方程式:
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.