题目内容
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
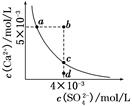

| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
C
A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

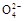 的溶液中肯定不存在Ag+
的溶液中肯定不存在Ag+
 。
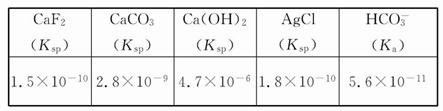
。

 。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为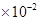 mol/L
mol/L  mol/L
mol/L