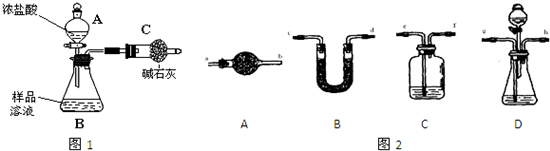
题目内容
甲同学设计如图所示装置研究氯气能否与水发生反应.
气体a的主要成分是含有少量空气和水蒸气的氯气.请回答下列问题:
(1)浓硫酸的作用是
(2)实现实验目的实验现象为
(3)装置C中发生反应的离子反应方程式为
(4)乙同学认为甲同学的实验不符合“绿色化学”的要求,若要使实验符合要求,应在装置
分析:氯气的实验室制备方法:浓盐酸和二氧化锰在加热条件下发生反应来制取,这样制取的氯气中含有水蒸气,要验证氯气和水能否反应,应该先干燥氯气,然后通过盛有干燥的有色布条B,有色布条不褪色说明氯气物漂白性,然后通过浸泡在水中的有色不条,若有色布条褪色就可以说明氯气和水反应生成了具有漂白性的物质.
注意尾气中含有未反应的氯气,所以不能直接排放到空气中.
注意尾气中含有未反应的氯气,所以不能直接排放到空气中.
解答:解:(1)A中制得的氯气中含有水蒸气,需要用浓硫酸干燥,故答案为:除去氯气中的水蒸气,干燥氯气;
(2)通过盛有干燥的有色布条B,有色布条不褪色说明氯气物漂白性,然后通过浸泡在水中的有色不条,若有色布条褪色就可以说明氯气和水反应生成了具有漂白性的物质,故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;
(3)装置C中氯气和水反应生成盐酸和次氯酸,离子方程式为:Cl2+H2O Cl-+H++HClO,故答案为:Cl2+H2O
Cl-+H++HClO,故答案为:Cl2+H2O Cl-+H++HClO;
Cl-+H++HClO;
(4)尾气中含有未反应的氯气,所以不能直接排放到空气中,应该在装置C后面添加尾气处理装置,故答案为:C;尾气处理.
(2)通过盛有干燥的有色布条B,有色布条不褪色说明氯气物漂白性,然后通过浸泡在水中的有色不条,若有色布条褪色就可以说明氯气和水反应生成了具有漂白性的物质,故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;
(3)装置C中氯气和水反应生成盐酸和次氯酸,离子方程式为:Cl2+H2O
 Cl-+H++HClO,故答案为:Cl2+H2O
Cl-+H++HClO,故答案为:Cl2+H2O Cl-+H++HClO;
Cl-+H++HClO;(4)尾气中含有未反应的氯气,所以不能直接排放到空气中,应该在装置C后面添加尾气处理装置,故答案为:C;尾气处理.
点评:本题考查氯气的化学性质以及氨气的实验室制备等方面的知识,属于综合实验考查,难度不大.

练习册系列答案
相关题目