题目内容
已知:H2O(g)═H2O(l)△H1=-Q1kJ?mol-1(Q1>0)
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)( )
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)( )
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.0.5Q1-1.5Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
①H2O(g)═H2O(l)△H1=-Q1kJ?mol-1(Q1>0),
②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0),
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0),
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-3Q1+Q2-Q3)kJ/mol,
即1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,
则23g液态乙醇完全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=(1.5Q1-0.5Q2+0.5Q3)kJ,
故选D.
②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0),
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0),
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-3Q1+Q2-Q3)kJ/mol,
即1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,
则23g液态乙醇完全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=(1.5Q1-0.5Q2+0.5Q3)kJ,
故选D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.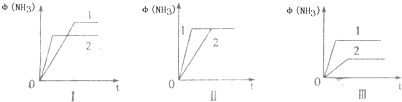
 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发