题目内容
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
|
族 |
|
|
|
|
|
|
|
0 |
|
1 |
IA |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
|
|
|
|
③ |
④ |
|
|
|
3 |
⑤ |
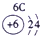
⑥ |
⑦ |
⑧ |
|
⑨ |
⑩ |
|
⑴⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
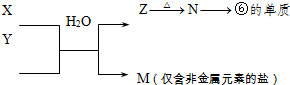
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
(1)S2->Cl->Na+>Mg2+
(2)H2O的沸点高于H2S,原因是液态水分子间存在氢键
(3)H2(g)+1/2 O2(g)=H2O(g) △H=" -2QkJ/mol"
或者2H2(g)+ O2(g)=2H2O(g) △H=" -" 4QkJ/mol
(4)C2H4
(5)酸 Al3++3H2O = Al(OH)3+3H+
(6)3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+
【解析】
试题分析:由图可得①号元素为H,②③④分别为C、N、O,⑤⑥⑦⑧⑨⑩分别为Na、Mg、Al、Si、S、Cl。(1)⑤⑥⑨⑩对应的离子分别为:Mg2+ 、Na+、S2-、Cl-,由具有相同核外电子层分布的离子,原子的序数越低其半径越大,所以半径:Na+>Mg2+,同理可得半径:S2->Cl-。又因为Na+、Mg2+的核外电子层数是2,而S2-、Cl-的核外电子层数是3,故⑤⑥⑨⑩的离子半径由大到小的顺序为S2->Cl->Na+>Mg2+
(2)④是O,⑨是S,二者对应的氢化物分别为H2O和H2S,由于液态水分子间存在氢键,所以H2O的沸点高于H2S。(3)①号元素为H, H2燃烧生成气态的水,lgH2在常温下完全燃烧生成气态产物放出Q kJ的热量,则1molH2的燃烧放出的热量为2Q,故表示H2燃烧的热化学方程式为:H2(g)+1/2 O2(g)=H2O(g) △H=" -2QkJ/mol" 。(4)⑨号元素是S,其电子数是16,由表中两种元素组成的电子数与⑨相同的化合物是
C2H4。(5)由⑦⑩两种元素组成的化合物是AlCl3,AlCl3在水中发生水解,所以其水溶液呈酸性,原因是: Al3++3H2O = Al(OH)3+3H+(6)④是O,⑤是Na,它们组成的化合物是: Na2O和Na2O2,由题意可知Fe2+被氧化,所以题中所说的化合物是Na2O2,发生反应的离子方程式为:3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+
考点:元素周期表中的短周期元素、元素周期律、氧化还原反应、热化学方程式的书写
点评:本题从短周期元素出发,考察了与它们相关的知识点,较为综合。但前5题难度不大,学生凭基础知识即可解决,最后一题难度有点大,需要学生将过氧化钠和过氧化氢联系起来,同时应用氧化还原的相关知识来解题。

 周期
周期 







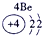
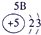
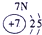
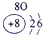
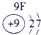
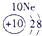
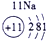





 表示的是
表示的是