题目内容
【题目】一种分解海水制氢气的方法为2H2O(l) ![]() 2H2(g)+O2(g)。下图为此反应的能量变化示意图,则下列说法错误的是
2H2(g)+O2(g)。下图为此反应的能量变化示意图,则下列说法错误的是

A.该反应正反应的活化能小于逆反应的活化能
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.使用氢气作燃料有利于控制温室效应
【答案】A
【解析】
A. 该反应反应物的总能量小于生成物的总能量,为吸热反应,ΔH=正反应的活化能-逆反应的活化能>0,因此有正反应的活化能大于逆反应的活化能,A项错误;
B. TiO2为催化剂,可以加快反应速率,即可以提高H2O的分解速率,B项正确;
C. 催化剂能降低反应的活化能,但对该反应的反应热无影响,C项正确;
D. 使用氢气作燃料,燃烧后的产物为水,不释放CO2,有利于控制温室效应,D项正确;
答案选A。

练习册系列答案
相关题目
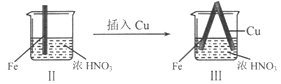
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化