题目内容
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:

已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)锆英石中锆元素的化合价为____________。
(2)氯化主反应:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。

(3)写出A12O3高温氯化过程中转化为AlC13的化学方程式___________________;
(4)Na2S、H2S、NaCN等均为常用的铜沉淀剂,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________(用离子方程式解释)。若盐酸溶解后溶液中c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)实验室进行萃取和反萃取的仪器是_______。流程中萃取与反萃取的目的是_________。
【答案】+4 360℃、1MPa 360℃以前反应未达到平衡,升温过程中反应继续向正向进行,产率不断增大;360℃以后反应达到平衡,由于该反应为放热反应,升温过程中平衡逆向移动,ZrCl4产率又减小 2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、烧杯 除去铁元素杂质
4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、烧杯 除去铁元素杂质
【解析】
(1)根据化合物中元素正负化合价代数和等于0,结合Si、O元素化合价分析;
(2)制取ZrC14产率最大时为最合适的反应条件;根据温度对化学反应速率和化学平衡移动的影响分析判断;
(3) A12O3、焦炭在高温下与氯气反应产生AlCl3、CO2,根据电子守恒、原子守恒可得反应方程式;
(4)锆英石(ZrSiO4)含有铁元素的氧化物,在处理过程中有Fe3+,根据Fe3+与H2S或S2-发生的氧化还原反应分析判断;根据Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10计算判断;
(5)根据萃取是分离互不相溶的液体混合物的方法判断仪器的使用;根据Fe(SCN)3难溶于MIBK;Zr(SCN)4在水中溶解度不大,易溶于MIBK分析萃取的目的。
(1)由于在化合物中元素正负化合价代数和等于0,O为-2价,Si为+4价,可得锆英石(ZrSiO4)中Zr元素的化合价为+4价;
(2)根据图像可知在ZrC14的产率在温度为360℃、1MPa时最高,说明氯化的最佳条件是360℃、1MPa;
根据图象可知:在360℃以前,随着温度的升高,ZrC14的产率逐渐增大,是由于温度升高,反应物分子的能量增加,有效碰撞次数增加,反应速率加快,更多的反应物发生反应变为生成物,所以ZrC14的产率逐渐增大,到360℃达到最大值,此时反应达到平衡状态,由于该反应的正反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使ZrC14的产率逐渐降低,因此温度升高,ZrC14的产率又逐渐降低;
(3) A12O3、焦炭在高温下与氯气反应产生AlCl3、CO2,根据电子守恒、原子守恒可得该反应方程式为:2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2;
4AlCl3+3CO2;
(4)在锆英石(ZrSiO4)含有铁元素的氧化物,在粉碎、氯化处理过程中有Fe3+生成,Fe3+具有氧化性,而H2S或S2-具有还原性,会发生氧化还原反应:2Fe3++H2S=2Fe2++S+2H+或2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S,影响Cu2+的沉淀,若用NaCN,就不会发生上述反应;由于Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10,c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)=![]() =2.00×10-4mol/L;
=2.00×10-4mol/L;
(5)由于萃取是分离互不相溶的液体混合物的方法,所以萃取和反萃取使用的仪器有分液漏斗和烧杯;在处理过程中Cu2+与沉淀试剂形成Cu(CN)2沉淀过滤除去,Fe3+与加入的NH4SCN形成络合物Fe(SCN)3,Zr4+形成Zr(SCN)4,由于Fe(SCN)3难溶于MIBK,而Zr(SCN)4在水中溶解度不大,易溶于MIBK,向Fe(SCN)3、Zr(SCN)4的混合溶液中加入MIBK充分振荡后,分液,可将Fe(SCN)3分离除去,然后向MIBK的溶液中加入硫酸进行反萃取,Zr(SCN)4进入硫酸溶液中,然后经过一系列处理,就可得到ZrO2。所以进行萃取和反萃取目的是除去铁元素杂质。

【题目】甘氨酸亚铁![]() 是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
甘氨酸( | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程
实验1制备![]() :将含
:将含![]() 的溶液与
的溶液与![]() 溶液混合,反应结束后过滤并洗涤沉淀。
溶液混合,反应结束后过滤并洗涤沉淀。
实验2制备![]() :
:
实验装置如图(夹持和加热仪器已省略),将实验1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反应将
中的反应将![]() 中空气排净,接着滴入柠檬酸溶液并加热。
中空气排净,接着滴入柠檬酸溶液并加热。
实验3提纯![]() :反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
:反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
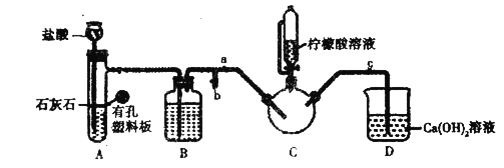
(1)写出实验1中制备![]() 的离子方程式_________________。
的离子方程式_________________。
(2)装盐酸的仪器名称是__________,装置![]() 中的试剂是__________。
中的试剂是__________。
(3)实验2中,打开![]() 关闭
关闭![]() ,排尽空气。确认
,排尽空气。确认![]() 中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
(4)实验2中的柠酸可调节溶液![]() ,体系
,体系![]() 与产率的关系如表
与产率的关系如表
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
体系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
产率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 过低产率下降的原因是________________________;柠檬酸的作用还有_______。
过低产率下降的原因是________________________;柠檬酸的作用还有_______。
(5)实验3中加入乙醇的目的是____________________。
(6)若产品的质量为![]() ,则产率为__________________%。
,则产率为__________________%。


