题目内容
【题目】![]() 环境科学
环境科学![]() 刊发了我国科研部门采用零价铁活化过硫酸钠
刊发了我国科研部门采用零价铁活化过硫酸钠![]() ,其中S为
,其中S为![]() 价
价![]() 去除废水中的正五价砷
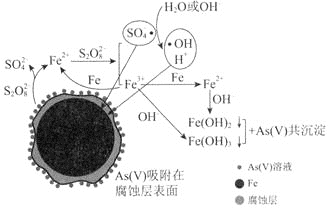
去除废水中的正五价砷![]() 的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为![]() ,
,![]() 。下列叙述正确的是
。下列叙述正确的是![]()
A.![]() 过硫酸钠
过硫酸钠![]() 含
含![]() 个过氧键
个过氧键
B.若![]() 参加反应,共有
参加反应,共有![]() 个
个![]() 被还原
被还原
C.室温下,中间产物![]() 溶于水所得饱和溶液中
溶于水所得饱和溶液中![]() 为
为![]()
D.pH越小,越有利于去除废水中的正五价砷
【答案】C
【解析】
A.根据化合价代数和为零的原则,设-1价的O有x个,-2价的O有y个,则有x+y=8,x+2y=2+2×6,解得x=2,y=6,2个-1价的O,则有1个过氧键;可得出1mol过硫酸钠![]() 含有
含有![]() 个过氧键,故A错误;
个过氧键,故A错误;
B.根据图示,可得出转化过程中Fe先被![]() 氧化为
氧化为![]() ,反应为
,反应为![]() ,然后
,然后![]() 进一步被
进一步被![]() 氧化为
氧化为![]() ,最后共沉淀中有
,最后共沉淀中有![]() 和
和![]() ,所以
,所以![]() 参加反应时,消耗的
参加反应时,消耗的![]() 超过
超过![]() 个,故B错误;
个,故B错误;
C.![]() 固体极难溶于水,
固体极难溶于水,![]() 的饱和溶液近似中性,溶液中的
的饱和溶液近似中性,溶液中的![]() 主要来源于水的电离,
主要来源于水的电离,![]() ,
,![]() ,可得
,可得![]() ,故C正确;
,故C正确;
D.酸性条件不利于形成![]() 和
和![]() 沉淀,难以与正五价砷发生共沉淀,故D错误;
沉淀,难以与正五价砷发生共沉淀,故D错误;
故选C。

【题目】若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4mol | 2mol | ||
CO | 2mol | 1mol | ||
CH3OH(g) | 0 | 0.7mol |
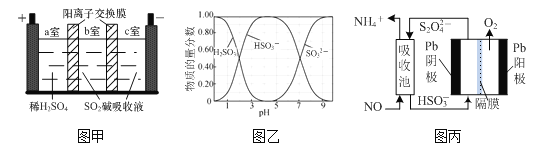
①下列各项能作为判断该反应达到平衡标志的是____________(填字母);
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=_________ (kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=__________kPamin-1。