题目内容
 中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知
中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知 H+(ap)+OH-(ap)=H2O(L);△H=-57.3kJ/mol 可见强酸强碱反应的中和热为57.3kJ/mol,现用50ml 0.55mol/L NaOH溶液进行中和反应(如图).通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)烧杯间填满碎纸条的作用是
(2)大烧杯上如不盖硬纸片,求得的中和热数值会
(3)实验中改用60ml 0.50mol/L盐酸跟50ml 0.55mol/L NaOH溶液进行反应,与上述实验相比,放出的热量会
考点:中和热的测定
专题:实验设计题
分析:(1)中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
解答:
解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减小热量散失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60ml 0.50mol/L盐酸跟50ml 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏大,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60ml 0.50mol/L盐酸跟50ml 0.55mol/L NaOH溶液进行上述实验,测得中和热数值相等,故答案为:偏大;无影响.
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60ml 0.50mol/L盐酸跟50ml 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏大,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60ml 0.50mol/L盐酸跟50ml 0.55mol/L NaOH溶液进行上述实验,测得中和热数值相等,故答案为:偏大;无影响.
点评:本题考查学生有关中和热的测定知识,注意理解中和热的概念,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知维生素A的结构简式如图.关于它的叙述正确的是( )


| A、维生素A的分子式为C20H30O |
| B、维生素A是一种易溶于水的醇 |
| C、维生素A分子中含有羟基、碳碳双键和苯环等官能团 |
| D、1mol维生素A最多可与7mol H2发生加成反应 |
已知C4H9-有4种同分异构体,不必写出C4H10O的结构简式,试说明其作为醇的同分异构体的数目( )
| A、2种 | B、4种 | C、3种 | D、5种 |
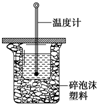 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: (1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.
(1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.