题目内容
卤素单质可以参与很多化学反应,如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;
反应①:2NH3+3F2
NF3+3NH4F
利用“化学蒸气转移法”制备TaS2晶体;
反应②:TaI4(g)+S2(g)?TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有 种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有 种自旋方向.
(2)反应①中:物质所属的晶体类型有 ;并写出所有原子符合8电子稳定结构的化合物的电子式 .
(3)反应②中:平衡常数表达式K= ,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 .
a.平衡常数K增大 b.S2的浓度减小 c.I2的质量减小 d.V(TaI4)逆增大
(4)反应②在一定温度下进行,若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则I2的平均反应速率为 .
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会 (填增大或减小),其原因是 .
反应①:2NH3+3F2
| Cu |
利用“化学蒸气转移法”制备TaS2晶体;
反应②:TaI4(g)+S2(g)?TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有
(2)反应①中:物质所属的晶体类型有
(3)反应②中:平衡常数表达式K=
a.平衡常数K增大 b.S2的浓度减小 c.I2的质量减小 d.V(TaI4)逆增大
(4)反应②在一定温度下进行,若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则I2的平均反应速率为
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会
考点:原子核外电子的运动状态,不同晶体的结构微粒及微粒间作用力的区别,反应速率的定量表示方法,化学平衡常数的含义,化学平衡的影响因素
专题:原子组成与结构专题,化学平衡专题
分析:(1)反应①中:非金属性最强的元素是F,原子中没有运动状态相同的电子,核外有几个电子就有几种不同运动状态的电子;氮气可作粮食保护气,最外层有5个电子,电子的自旋方向有2种;
(2)共价物质的组成分析晶体的类型;对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构;,然后书写电子式;
(3)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;该反应为放热反应,降低温度,平衡正向移动;
a.降低温度,平衡正向移动,平衡常数K增大;
b.平衡正向移动,S2的浓度减小;
c.平衡正向移动,I2的质量增大;
d.温度降低,速率减小;
(4)反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,依据化学方程式的气体质量变化计算反应I2物质的量,依据化学反应速率概念计算;
(5)根据S2会转变成S4、S6、S8,反应物气体的物质的量偏小.
(2)共价物质的组成分析晶体的类型;对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构;,然后书写电子式;
(3)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;该反应为放热反应,降低温度,平衡正向移动;
a.降低温度,平衡正向移动,平衡常数K增大;
b.平衡正向移动,S2的浓度减小;
c.平衡正向移动,I2的质量增大;
d.温度降低,速率减小;
(4)反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,依据化学方程式的气体质量变化计算反应I2物质的量,依据化学反应速率概念计算;
(5)根据S2会转变成S4、S6、S8,反应物气体的物质的量偏小.
解答:
解:(1)反应①中:非金属性最强的元素是F,F原子中有9个电子,就有9种不同运动状态的电子;氮气可作粮食保护气,最外层有5个电子,电子的自旋方向有2种;
故答案为:9;2;
(2)NH3、F2、NF3属于分子晶体,NH4F属于离子晶体,Cu属于金属晶体;
NF3中N元素化合价为+3,N原子最外层电子数为5,所以3+5=8,分子中N原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+6=8,分子中F原子满足8电子结构,电子是为: ;
;
故答案为:分子晶体、离子晶体、金属晶体; ;
;
(3)反应TaI4(g)+S2(g)?TaS2(s)+2I2(g)体系中,平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
;
该反应为放热反应,降低温度,平衡正向移动;
a.降低温度,平衡正向移动,平衡常数K增大,故正确;
b.平衡正向移动,S2的浓度减小,故正确;
c.平衡正向移动,I2的质量增大,故错误;
d.温度降低,V(TaI4)逆减小,故错误;
故答案为:
;ab;
(4)若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,
TaI4(g)+S2(g)?TaS2(s)+2I2(g)△m
2mol 245g
0.02mol 2.45g
生成的I2为0.02mol,则I2的平均反应速率=
=0.00333mol/(L?min);
故答案为:0.00333mol/(L?min);
(5)S2会转变成S4或S6或S8,反应物气体的物质的量偏小,所以增大压强,平衡逆向移动,TaI4的平衡转化率减小;
故答案为:减小;增大压强,TaI4的平衡转化率减小的原因是S2会转变成S4或S6或S8.
故答案为:9;2;
(2)NH3、F2、NF3属于分子晶体,NH4F属于离子晶体,Cu属于金属晶体;
NF3中N元素化合价为+3,N原子最外层电子数为5,所以3+5=8,分子中N原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+6=8,分子中F原子满足8电子结构,电子是为:
 ;
;故答案为:分子晶体、离子晶体、金属晶体;
 ;
;(3)反应TaI4(g)+S2(g)?TaS2(s)+2I2(g)体系中,平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
| C2(I 2) |
| C(TaI4)C(S2) |
该反应为放热反应,降低温度,平衡正向移动;
a.降低温度,平衡正向移动,平衡常数K增大,故正确;
b.平衡正向移动,S2的浓度减小,故正确;
c.平衡正向移动,I2的质量增大,故错误;
d.温度降低,V(TaI4)逆减小,故错误;
故答案为:
| C2(I 2) |
| C(TaI4)C(S2) |
(4)若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,
TaI4(g)+S2(g)?TaS2(s)+2I2(g)△m
2mol 245g
0.02mol 2.45g
生成的I2为0.02mol,则I2的平均反应速率=
| ||
| 3min |
故答案为:0.00333mol/(L?min);
(5)S2会转变成S4或S6或S8,反应物气体的物质的量偏小,所以增大压强,平衡逆向移动,TaI4的平衡转化率减小;
故答案为:减小;增大压强,TaI4的平衡转化率减小的原因是S2会转变成S4或S6或S8.
点评:本题是道综合题,涉及电子的运用状态、晶体类型、电子式、化学反应速率以及平衡常数、平衡移动原理,难度中等.

练习册系列答案
相关题目
下列关于氢键的说法正确的是( )
| A、由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 |
| B、氢键只能存在于分子间,不能存在于分子内 |
| C、在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小 |
| D、相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多 |
下列各组离子一定能大量共存的是( )
| A、在c(HCO3-)=0.1mol?L-1的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在与铝反应放出氢气的溶液中:K+、SO42-、Br-、Na+ |
| C、25℃,在由水电离出的c(H+)=10-13mol?L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D、在能使甲基橙变红的溶液中:K+、Fe2+、Cl-、NO3- |

 中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知
中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知 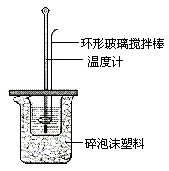 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题 根据中和热的测定实验填空.
根据中和热的测定实验填空.