题目内容
已知合成氨的反应为3H2(g)+N2(g)?2NH3(g)△H<0,在某密闭容器中测得实验数据及数据处理如表.
(1)下列说法可以说明合成氨反应达到平衡的是
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向 方向移动(填“正”或“逆”),请画出在t2时刻升温后的图1,并作出必要的标注.
(3)表中实验2的K2= ,温度T1、T2的大小关系是 ,你判断的理由是 .
| 组别 | 起始浓度c/mol?dm3 | 平衡浓度c/mol?dm3 | K | 温度T | ||||
| H2 | N2 | NH3 | H2 | N2 | NH3 | |||
| 实验1 | 1.9868 | 1.356 | 0 | 1.35 | 1.15 | 0.412 | 5.98×10-2 | T1 |
| 实验2 | 0.6405 | 1.0435 | 0 | C1 | C2 | C3 | K2 | T1 |
| 实验3 | 0.6405 | 1.0435 | 0 | 0.51 | 1.00 | 0.087 | 6.05×10-2 | T2 |
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向

(3)表中实验2的K2=
考点:化学平衡状态的判断,用化学平衡常数进行计算,化学平衡的影响因素
专题:
分析:(1)平衡时正逆反应速率相等,来分析判断;
(2)升高温度平衡向吸热反应方向移动,升温正逆反应速率都加快,逆反应速率加快的大,平衡逆向移动;
(3)平衡时生成物的浓度幂之积比上反应物浓度幂之积,而与实验1的温度相同,所以与实验的K相同,正反应是放热反应温度越高K值越小.
(2)升高温度平衡向吸热反应方向移动,升温正逆反应速率都加快,逆反应速率加快的大,平衡逆向移动;
(3)平衡时生成物的浓度幂之积比上反应物浓度幂之积,而与实验1的温度相同,所以与实验的K相同,正反应是放热反应温度越高K值越小.
解答:
解:(1)A.恒容时,整个容器内密度一直不变,故A错误;
B.恒压时,容器内平均相对分子质量不变,说明物质的量不变,正逆反应速率相等,故B正确;
C.1mol N≡N键断裂的同时,有3mol H-H键断裂,未反映正与逆的关系,故C错误;
故选B;
(2)升高温度平衡向吸热反应方向移动,所以逆向移动,升温正逆反应速率都加快,逆反应速率加快的大,平衡逆向移动,图象为: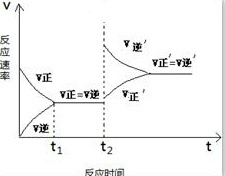 ,故答案为:逆;
,故答案为:逆; ;
;
(3)K=
=5.98×10-2,实验3时K=6.05×10-2,平衡常数增大,正反应是放热反应,所以温度降低,故答案为:5.98×10-2;T1>T2;实验1到实验3,平衡常数增大,正反应是放热反应,所以温度降低.
B.恒压时,容器内平均相对分子质量不变,说明物质的量不变,正逆反应速率相等,故B正确;
C.1mol N≡N键断裂的同时,有3mol H-H键断裂,未反映正与逆的关系,故C错误;
故选B;
(2)升高温度平衡向吸热反应方向移动,所以逆向移动,升温正逆反应速率都加快,逆反应速率加快的大,平衡逆向移动,图象为:
 ,故答案为:逆;
,故答案为:逆; ;
;(3)K=
| 0.4122 |
| 1.353×1.15 |
点评:本题考查化学平衡常数和平衡的移动,学生只要知道平衡常数的意义和平衡移动的原理就可以迅速解题,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知32g X与40g Y恰好完全反应,生成mg Q和9g H.该反应生成0.5mol Q,则Q物质的摩尔质量是( )
| A、63g?mol-1 |
| B、122g?mol-1 |
| C、126g?mol-1 |
| D、163g?mol-1 |
1个标准大气压,120℃时,1体积某气态烃和8体积足量O2混合点燃,充分燃烧后恢复至原状况,混合气体的密度减少了
,则原气态烃的分子式可能是( )
①C3H8 ②C2H6 ③C2H2 ④C4H8.
| 1 |
| 10 |
①C3H8 ②C2H6 ③C2H2 ④C4H8.
| A、①④ | B、①② | C、②④ | D、③④ |
下列依据热化学方程式得出的结论正确的是( )
| A、已知 C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | ||
B、已知 C(s)+O2(g)=CO2(g)△H1 C(s)+
| ||
| C、已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则1mol氢气完全燃烧放出的热量为241.8kJ | ||
| D、已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含 20gNaOH 的稀溶液与稀盐酸完全中和,中和热为 28.65kJ/mol |
标准状况下,在三个烧瓶内分别装有纯净干燥的NH3、含一半空气的氯化氢气体、NO2和O2体积比为4:1的混合气体.然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则它们的物质的量浓度之比为( )
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |