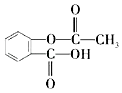
题目内容
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4 L空气含有NA个单质分子
B.常温常压下,0.1 mol Na2CO3含有的Na+数目为0.2NA
C.标准状况下,22.4 L H2O含有的分子数为 NA
D.物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
【答案】B
【解析】空气是多种成分组成的混合物,不只含有单质,A项错误;1 mol碳酸钠中含2 mol钠离子,故0.1 mol碳酸钠中含0.2 mol即0.2NA个钠离子,B项正确;标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,C项错误;溶液体积不明确,故溶液中的Cl个数无法计算,D项错误。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目