题目内容
11.高铁酸钾(K2Fe04)、明矾[KAl(SO4)2•12H2O]都是常用的水处理剂.回答下列问题:(1)K+的结构示意图为
 .
.(2)与H2O分子所含电子数相等的四原子分子是NH3(填化学式)
(3)组成KAl(SO4)2的元素对应的简单离子K+、Al3+、S2-、O2-中,半径最小的是O2-.
(4)列举一例说明氧的非金属性比硫的强:O2+2H2S=2S+2H2O.
(5)高铁酸钾中长周期主族元素是K.
分析 (1)钾原子核电荷数为19,核外有四个电子层,最外层为1个电子,失去最外层电子形成钾离子,根据粒子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层;
(2)与H2O分子所含电子数相等的四原子分子是氨气分子;
(3)离子半径中电子层数越多,半径越大,电子层数相同的核电荷数越大,半径越小;
(4)氧化还原反应中氧化剂氧化性大于氧化产物;
(5)元素周期表中,短周期表为1、2、3周期,长周期为4、5、6周期,高铁酸钾中Fe为副族元素,以此来解答.
解答 解:(1)根据粒子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层,钾离子的结构示意图是: ,
,
故答案为: ;
;
(2)与H2O分子所含电子数相等的四原子分子是氨气分子,化学式为NH3,
故答案为:NH3;
(3)组成KAl(SO4)2的元素对应的简单离子K+、Al3+、S2-、O2-中,K+、Al3+、S2-三个电子层,O2-两个电子层半径最小,
故答案为:O2-;
(4)氧化还原反应中氧化剂氧化性大于氧化产物,氧气的氧化性大于硫单质,说明氧的非金属性比硫的强,O2+2H2S=2S+2H2O,
故答案为:O2+2H2S=2S+2H2O;
(5)高铁酸钾中含有钾元素、铁元素、氧元素,铁元素是长周期中的缔ⅤⅢ族元素,氧元素是短周期中的主族元素,所以其中属于长周期主族元素是K元素,第四周期第ⅠA族元素,
故答案为:K;
点评 本题考查了微粒结构、微粒性质的应用,主要是氧化还原反应,元素位置、微粒结构等知识,题目较简单.

练习册系列答案
相关题目
2.五种短周期元素的部分性质数据如下:下列叙述正确的是( )
| 元素 | T | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
| A. | X的阴离子半径小于T的阳离子半径 | |
| B. | Y的氢化物的热稳定性比Z的氢化物的小 | |
| C. | Y单质与Fe反应生成的化合物中,铁元素显+3价 | |
| D. | Z元素的氧化物对应的水化物一定为强酸 |
5.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3 H2S CO2 | |
| B. | H2O NH3•H2O HClO HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
2.标准状况下,3.25g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是( )
| A. | Zn+2HCl═ZnCl2+H2↑ 1mol 1mol 3.25g x L | |
| B. | Zn+2HCl═ZnCl2+H2↑ 65g 1L 3.25g x L | |
| C. | Zn+2HCl═ZnCl2+H2↑ 1mol 22.4L 0.05mol x L | |
| D. | Zn+2HCl═ZnCl2+H2↑ 65g 1mol 3.25g x L |
3.将红磷和硫分别在如图所示的两个盛满O2的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )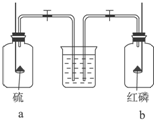

| A. | 水先进入a瓶 | B. | 水先进入b瓶 | ||
| C. | 水同时进入两瓶 | D. | 水不进入任何一瓶 |
 ,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.
,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.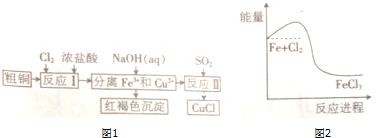
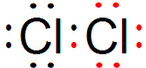 .
.