题目内容
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
|
阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中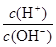 =
;
=
;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
(1)Na2CO3 NH4Cl Ba(OH)2 Na2SO4
(2)10-6
(3)3 : 2
(4)c(OH-)>c(Cl-)=c(Ba2+)>c(NH4+)>c(H+)
【解析】
试题分析:①A、C溶液的pH均大于7,说明A、C是碱或者是强碱弱酸盐,A、B的溶液中水的电离程度比纯水大,说明A、B均含有弱根离子。A、D焰色反应的火焰均为黄色,说明A、D均含有钠元素。
②C溶液和D溶液相遇时只观察到有白色沉淀产生,白色沉淀可能是碳酸钡或者硫酸钡。B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,刺激性气味的气体是氨气。A溶液和D溶液混合时无明显现象。综合以上信息可知A是Na2CO3 ,B是NH4Cl C是Ba(OH)2 D是Na2SO4
(2)常温,将1 ml pH =12的Ba(OH)2溶液加水稀释至100ml,强碱溶液每稀释10倍,pH下降1.则稀释后pH=10。c(H+)=10-10,c(OH-)=10-4,所得溶液中 =10-6。
=10-6。
(3)常温下,0.15 mol·L-1的Ba(OH)2溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13。设C溶液的体积为V1与盐酸的体积为V2,则0.15mol/L*2 V1—0.02 mol/L* V2=0.1 mol/L*(V1+ V2)。解得V1/ V2=3 : 2。
(4)将等体积、等物质的量浓度的NH4Cl溶液和Ba(OH)2溶液混合,NH4 +和OH-结合生成氨水。导致NH4 +和OH-的离子浓度下降。所以反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Cl-)=c(Ba2+)>c(NH4+)>c(H+) 。
考点:物质推断,离子浓度大小的比较,pH计算

 黄冈创优卷系列答案
黄冈创优卷系列答案



