题目内容
有A、B、C、D四种元素,它们的核电荷数依次增大.已知:
①A原子最外层电子数是次外层电子数的两倍.D原子M层上的电子比K层多5个.
②B的阴离子与跟氖原子的电子层结构相同.0°C、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g.
③C与B构成的CB2中,C的质量分数为50%.在C原子核中,质子数与中子数相同.
回答:
(1)写出A~D各元素的名称:A 、B 、C 、D .
(2)写出下列微粒的结构示意图或电子式.
①B的阴离子的电子式 ;
②C的离子的结构示意图 ;
③D的阴离子的电子式 .
①A原子最外层电子数是次外层电子数的两倍.D原子M层上的电子比K层多5个.
②B的阴离子与跟氖原子的电子层结构相同.0°C、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g.
③C与B构成的CB2中,C的质量分数为50%.在C原子核中,质子数与中子数相同.
回答:
(1)写出A~D各元素的名称:A
(2)写出下列微粒的结构示意图或电子式.
①B的阴离子的电子式
②C的离子的结构示意图
③D的阴离子的电子式
分析:A、B、C、D四种元素,它们的核电荷数依次增大.已知:
①A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;D原子M层上的电子比K层多5个,则其M层电子数为7,故D为Cl;
②0℃、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g,则B2气体的摩尔质量=
=32g/mol,B的阴离子与跟氖原子的电子层结构相同,故B为O元素;
③C与B构成的CB2中,C的质量分数为50%,则C的相对原子质量=32,在C原子核中,质子数与中子数相同,故其质子数为16,则C为S元素,据此解答.
①A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;D原子M层上的电子比K层多5个,则其M层电子数为7,故D为Cl;
②0℃、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g,则B2气体的摩尔质量=
| 6.4g |
| 0.2mol |
③C与B构成的CB2中,C的质量分数为50%,则C的相对原子质量=32,在C原子核中,质子数与中子数相同,故其质子数为16,则C为S元素,据此解答.
解答:解:A、B、C、D四种元素,它们的核电荷数依次增大.已知:
①A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;D原子M层上的电子比K层多5个,则其M层电子数为7,故D为Cl;
②0℃、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g,则B2气体的摩尔质量=
=32g/mol,B的阴离子与跟氖原子的电子层结构相同,故B为O元素;
③C与B构成的CB2中,C的质量分数为50%,则C的相对原子质量=32,在C原子核中,质子数与中子数相同,故其质子数为16,则C为S元素,
(1)由上述分析可知,A、B、C、D分别为:碳,氧,硫,氯,故答案为:碳;氧;硫;氯;
(2)①B的阴离子为O2-,其电子式为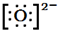 ,故答案为:
,故答案为: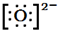 ;
;
②S2-离子核外电子数为18,有3个电子层,最外层电子数为8,其结构示意图为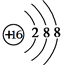 ,故答案为:
,故答案为: ;
;
③D的阴离子为Cl-,其电子式为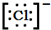 ,故答案为:
,故答案为: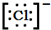 .
.
①A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;D原子M层上的电子比K层多5个,则其M层电子数为7,故D为Cl;
②0℃、101.3KPa时B可形成B2气体,经测定0.2mol B2气体为6.4g,则B2气体的摩尔质量=
| 6.4g |
| 0.2mol |
③C与B构成的CB2中,C的质量分数为50%,则C的相对原子质量=32,在C原子核中,质子数与中子数相同,故其质子数为16,则C为S元素,
(1)由上述分析可知,A、B、C、D分别为:碳,氧,硫,氯,故答案为:碳;氧;硫;氯;
(2)①B的阴离子为O2-,其电子式为
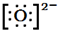 ,故答案为:
,故答案为: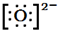 ;
;②S2-离子核外电子数为18,有3个电子层,最外层电子数为8,其结构示意图为
 ,故答案为:
,故答案为: ;
;③D的阴离子为Cl-,其电子式为
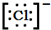 ,故答案为:
,故答案为: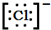 .
.点评:本题考查结构性质位置关系,侧重对电子式等化学用语的考查,难度不大,注意掌握电子式的书写.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目




