题目内容
(1)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:
A+B→白色沉淀 B+D→白色沉淀 C+D→蓝色沉淀
写出上述反应对应的离子方程式:
A+B→白色沉淀:
B+D→白色沉淀:
C+D→蓝色沉淀:
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,写出发生反应的离子方程式:
A+B→白色沉淀 B+D→白色沉淀 C+D→蓝色沉淀
写出上述反应对应的离子方程式:
A+B→白色沉淀:
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
;B+D→白色沉淀:
Mg2++2OH-=Mg(OH)2↓
Mg2++2OH-=Mg(OH)2↓
;C+D→蓝色沉淀:
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
.(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,写出发生反应的离子方程式:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
.分析:(1)用表格法进行分析,将溶液两两混合的现象结果记入右表,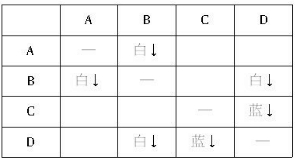
发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH;
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,SO42-过量,H+恰好反应.

发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH;
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,SO42-过量,H+恰好反应.
解答:解:(1)用表格法进行分析,将溶液两两混合的现象结果记入右表,
发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
AgNO3、MgCl反应的离子方程式为Ag++Cl-=AgCl↓;
MgCl2、NaOH反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
CuSO4、NaOH反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
故答案为:Ag++Cl-=AgCl↓;Mg2++2OH-=Mg(OH)2↓;Cu2++2OH-=Cu(OH)2↓;
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,SO42-过量,H+恰好反应,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.

发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
AgNO3、MgCl反应的离子方程式为Ag++Cl-=AgCl↓;
MgCl2、NaOH反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
CuSO4、NaOH反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
故答案为:Ag++Cl-=AgCl↓;Mg2++2OH-=Mg(OH)2↓;Cu2++2OH-=Cu(OH)2↓;
(2)向NaHSO4 溶液中逐滴加入Ba(OH)2 溶液至溶液呈中性,SO42-过量,H+恰好反应,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O.
点评:本题综合考查物质的检验和鉴别的实验方案的设计和评价,侧重于考查学生综合运用化学知识的能力和分析问题的能力,根据反应现象进行推断,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目