题目内容
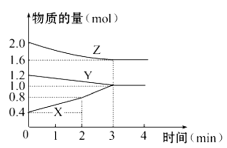
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:
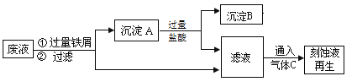
(1)沉淀A中含有的单质是 。
(2)通入的气体C的化学式是 。
(3)滤液与气体C反应生成刻蚀液的离子方程式: 。
【答案】(1)Fe、Cu (2)Cl2 (3) 2Fe2++Cl2=2Fe3++2Cl-
【解析】
试题分析:(1)铁离子、铜离子均能与铁反应,分别生成亚铁离子,亚铁离子和铜,由于铁过量,则沉淀A中含有的金属单质是Fe、Cu。
(2)A中加入盐酸,铁溶解生成氯化亚铁,铜不溶解,过滤得到沉淀B是铜,滤液是氯化亚铁,要再转化为氯化铁,需要通入氯气将氯化亚铁转化为氯化铁。
(3)氯气与氯化亚铁反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。

练习册系列答案
相关题目