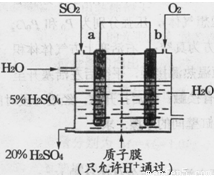
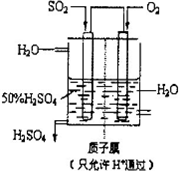
��Ŀ����
[ ]
B��N2��H2��ת���ʲ����
C��ƽ��ʱ��H2��NH3����������֮��Ϊ3 : 2
D��x��ȡֵ��ΧΪ0��x��0.14

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���ҵ������Ϊԭ��(����Ͻ���Ϊ����)��������������Ĺ������£�
|


 ��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)��
��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)��
��2�����᳧β�����õĴ��������Ǵ���ԭ������������ʱ��H2��NO2��ԭΪN2 ����֪��
2H2(g)+O2(g)=2H2O(g) ��H= a kJ��mol��1
N2(g)+2O2(g)=2NO2(g) ��H= b kJ��mol��1
H2O(1)=H2O(g) ��H= c kJ��mol��1
��Ӧ2NO2(g)+4H2(g)=N2(g)+4H2O(1)�ġ�H=_________��(��a��b��c��ʾ)
��3���ٺϳɰ���Ӧ�Ļ�ѧ����ʽΪN2+3H2 2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��3v��(N2)=v��(H2)
C��������ѹǿ���ֲ���
D������������Է����������ֲ���
E��1mol N��N�����ѣ�ͬʱ1mol H��H������
�����ں��������£���N2��H2��һ���������ͨ��һ���ݻ�Ϊ2L���ܱ������У�5min��Ӧ��ƽ�⣬n(N2)=1mol��n(H2)=1mol��n(NH3)=2mol����Ӧ����v(N2)=________________��H2��ƽ��ת����=_________________���������������¶Ȳ��䣬��10minʱ���������ݻ�ѹ��ΪlL�����ڴ������ͼ�У������ӷ�Ӧ��ʼ��15minʱc(NH3)��ʱ��仯����ʾ��ͼ��


 ��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮
��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮 2SO3��g�� ��H=-197 kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱����
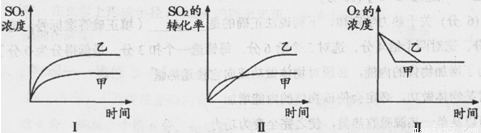
2SO3��g�� ��H=-197 kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱���� 2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����
2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����