题目内容
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为

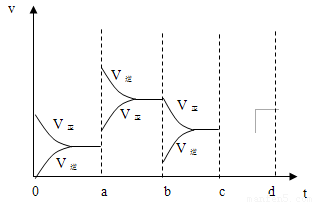
(2)图1表示在密闭容器中反应:2SO2+O2?2SO3,△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,图2表示酶参加的反应中,温度与反应速率的关系.解释曲线变化原因
2mol/(L?min)
2mol/(L?min)
,用O2浓度变化来表示的反应速率为1mol/(L?min)
1mol/(L?min)
.如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为2mol/L
2mol/L
.
(2)图1表示在密闭容器中反应:2SO2+O2?2SO3,△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
升高温度
升高温度
;b c过程中改变的条件可能是减小SO3浓度
减小SO3浓度
; 若增大压强时,反应速度变化情况画在c~d处.(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,图2表示酶参加的反应中,温度与反应速率的关系.解释曲线变化原因
开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低
开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低
.分析:(1)根据反应速率v=
及化学反应速率与化学计量数的关系计算出二氧化硫、氧气的反应速率;根据n=v?V?t计算出2min时SO2的浓度;
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;
(3)根据酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性分析.
| △c |
| △t |
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;
(3)根据酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性分析.
解答:解:(1)2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=
=2mol/(L?min),
用O2浓度变化来表示的反应速率为:v(O2)=
×2mol/(L?min)=1mol/(L?min),
如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),
二氧化硫的反应速率为:v(SO2)=2v(O2)=2×0.5mol/(L?min)=1mol/(L?min),反应消耗的二氧化硫的物质的量浓度为:n(SO2)=1mol/(L?min)×2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,
故答案为:2mol/(L?min);1mol/(L?min);2mol/L;
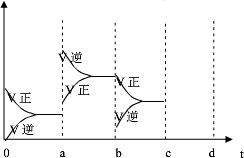
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为: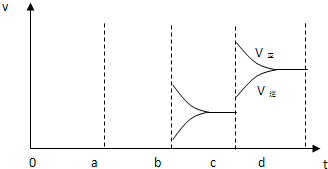 ,
,
故答案为:升高温度;减小SO3浓度;
 ;
;
(3)酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性,失去催化活性,
故答案为:开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低.
| 6mol/L-2mol/L |
| 2min |
用O2浓度变化来表示的反应速率为:v(O2)=
| 1 |
| 2 |
如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),
二氧化硫的反应速率为:v(SO2)=2v(O2)=2×0.5mol/(L?min)=1mol/(L?min),反应消耗的二氧化硫的物质的量浓度为:n(SO2)=1mol/(L?min)×2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,
故答案为:2mol/(L?min);1mol/(L?min);2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为:
 ,
,故答案为:升高温度;减小SO3浓度;
 ;
;(3)酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性,失去催化活性,
故答案为:开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低.
点评:本题考查了化学反应速率与化学平衡的图象问题,题目难度不大,注意把握曲线的变化趋势以及外界条件对化学平衡的影响,试题贴近高考,针对性强,有利于激发学生的学习兴趣和学习积极性,侧重考查学生分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。