题目内容
已知氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2++2OH-
Ca2++2OH-
在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏(CaSO4·2H2O)。
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:_____________________________________________;
②SO2与Ca(OH)2悬浊液反应:____________________________________________。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水洗涤废气的理由:________________。
解析:石膏的化学式是CaSO4·2H2O,注意不要与生石膏2CaSO4·H2O混淆。
SO2溶于水生成H2SO3:H2O+SO2![]() H2SO3①
H2SO3①
但产物为CaSO4·2H2O,显然是H2SO3被氧化成了H2SO4:2H2SO3+O2══2H2SO4②
H2SO4既可与CaCO3,又可与Ca(OH)2反应:
H2O+CaCO3+H2SO4══CaSO4·2H2O+CO2↑③
Ca(OH)2+H2SO4══CaSO4·2H2O④
将①②③或①②④叠加可得答案。
答案:(1)①2SO2+O2+2CaCO3+4H2O══2(CaSO4·2H2O)+2CO2
②2SO2+O2+2Ca(OH)2+2H2O══2(CaSO4·2H2O)
(2)因为Ca(OH)2微溶于水,用澄清石灰水时,Ca(OH)2浓度低,不利于SO2的吸收

练习册系列答案
相关题目
 、
、 、
、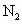 、
、 等,为了除去有害气体
等,为了除去有害气体 悬浊液反应:________
悬浊液反应:________ 悬浊液反应:________
悬浊液反应:________