题目内容
【题目】简答题:
(1)NH4Cl溶液呈 , 用离子方程式表示原因 .
(2)普通泡沫灭火器的钢铁容器里装着一只小玻璃筒,其中玻璃筒内盛装溶液,使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫.产生此现象的离子方程式是 .
(3)NaHSO3溶液呈性,原因 .
(4)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
【答案】
(1)酸性;NH4++H2O═NH3·H2O+H+
(2)Al2(SO4)3;Al3++3HCO ![]() =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
(3)酸性;HSO ![]() 的电离程度大于水解程度
的电离程度大于水解程度
(4)Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2+2NH ![]()
【解析】解;(1)NH4Cl为强酸弱碱盐,其溶液呈酸性,离子方程式为NH4++H2ONH3H2O+H+ , 故答案为:酸性;NH4++H2ONH3H2O+H+;(2)Al2(SO4)3水解显酸性,不能放在铁筒中,所以玻璃筒内盛装Al2(SO4)3;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO ![]() =Al(OH)3↓+3CO2↑;故答案为:Al2(SO4)3;Al3++3HCO
=Al(OH)3↓+3CO2↑;故答案为:Al2(SO4)3;Al3++3HCO ![]() =Al(OH)3↓+3CO2↑;(3)NaHSO3既水解又电离,HSO
=Al(OH)3↓+3CO2↑;(3)NaHSO3既水解又电离,HSO ![]() 的电离程度大于水解程度,电离显酸性,所以溶液显酸性;故答案为:酸性;HSO
的电离程度大于水解程度,电离显酸性,所以溶液显酸性;故答案为:酸性;HSO ![]() 的电离程度大于水解程度;(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2 , 反应的离子方程式为Cu2++2NH3H2O=Cu(OH)2↓+2NH4+ , 故答案为:Cu(OH)2;Cu2++2NH3H2O=Cu(OH)2↓+2NH
的电离程度大于水解程度;(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2 , 反应的离子方程式为Cu2++2NH3H2O=Cu(OH)2↓+2NH4+ , 故答案为:Cu(OH)2;Cu2++2NH3H2O=Cu(OH)2↓+2NH ![]() . (1)NH4Cl为强酸弱碱盐,其溶液呈酸性;(2)Al2(SO4)3水解显酸性,不能放在铁桶中;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;(3)NaHSO3既水解又电离,以电离为主;(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
. (1)NH4Cl为强酸弱碱盐,其溶液呈酸性;(2)Al2(SO4)3水解显酸性,不能放在铁桶中;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;(3)NaHSO3既水解又电离,以电离为主;(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题: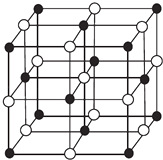
(1)写出C、D、E三种原子第一电离能由大到小的顺序为 . (用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为 .
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC﹣ . 与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示) .
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
根据表格中的数据:判断KCl、MgO、TiN三种离子晶体熔点从高到低的顺序是 . MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是 .