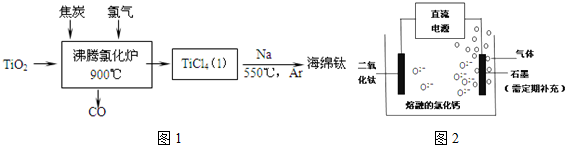
题目内容
4.硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2SO3).某化学课外活动小组利用下列装置来测定硫代硫酸钠样品中亚硫酸钠的含量.(已知Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O)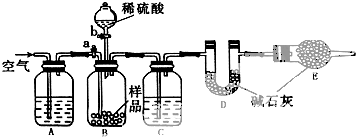
(1)写出硫代硫酸钠与稀硫酸反应的化学方程式Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.
(2)组装仪器前,甲同学用装置B、C检验产生的气体,则装置C中应盛有品红,观察到现象为品红溶液褪色.
(3)乙同学称取m1g硫代硫酸钠样品进行实验.
①组装好上述仪器后,应首先进行的实验操作是检验装置的气密性;
②为了较准确地测得实验结果,装置A、C中应分别盛有氢氧化钠溶液和浓硫酸.
③装置B中滴入过量稀H2SO4且充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间,其目的是将装置中的二氧化硫排除以被D完全吸收.
④若实验前后装置C的质量分别为m2g、m3g,装置D的质量分别为m4g、m5g,则求样品中Na2SO3的质量分数(设为a)的计算式为$\frac{{m}_{5}-{m}_{4}}{64}$=$\frac{{m}_{1}(1-a)}{158}$+$\frac{{m}_{1}a}{126}$.
分析 (1)硫代硫酸钠与稀硫酸反应生成二氧化硫、硫、硫酸钠和水
(2)反应生成的二氧化硫具有漂白性,可以使品红溶液褪色检验二氧化硫的存在;
(3)①分析装置图是利用D吸收生成的二氧化硫计算,需要检查装置气密性;
②为了准确测定二氧化硫气体的质量,需要防止空气中的二氧化碳、水蒸气对测定结果的干扰,利用空气通入把生成的气体全部赶入装置D中吸收,需要先通过氢氧化钠溶液吸收空气中的二氧化碳,生成的气体中含有水蒸气需要通过装置C中的浓硫酸干燥;
③充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间是为了把生成的气体全部赶入装置D中完全吸收;
④依据装置D吸收气体质量变化计算生成的二氧化硫质量,二氧化硫是亚硫酸钠和硫代硫酸钠于硫酸反应生成列式计算;
解答 解:(1)硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2SO3),Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,
故答案为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O;
(2)硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2SO3),Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,生成的二氧化硫具有漂白性,可以使品红溶液褪色,可以检验二氧化硫的存在,装置C中应盛有品红溶液;
故答案为:品红,品红溶液褪色;
(3)①分析装置图是利用D吸收生成的二氧化硫计算,需要检查装置气密性;
故答案为:检查装置气密性;
②为了准确测定二氧化硫气体的质量,需要防止空气中的二氧化碳、水蒸气对测定结果的干扰,利用空气通入把生成的气体全部赶入装置D中吸收,需要先通过氢氧化钠溶液吸收空气中的二氧化碳,生成的气体中含有水蒸气需要通过装置C中的浓硫酸干燥,装置A、C中应分别盛有;氢氧化钠溶液,浓硫酸溶液;
故答案为:氢氧化钠溶液,浓硫酸溶液;
③充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间是为了把生成的气体全部赶入装置D中完全吸收,减少测定误差;
故答案为:将装置中的二氧化硫排除以被D完全吸收;
④依据装置D吸收气体质量变化计算生成的二氧化硫质量,二氧化硫是亚硫酸钠和硫代硫酸钠于硫酸反应生成列式计算,装置D的质量分别为m4 g、m5 g,吸收的二氧化硫质量为m5 g、m54g,;样品中Na2SO3的质量分数为a,则硫代硫酸钠的质量=m1(1-a)g,亚硫酸钠的质量为m1ag,依据硫元素守恒计算生成的二氧化硫物质的量:$\frac{{m}_{5}-{m}_{4}}{64}$=$\frac{{m}_{1}(1-a)}{158}$+$\frac{{m}_{1}a}{126}$,
故答案为:$\frac{{m}_{5}-{m}_{4}}{64}$=$\frac{{m}_{1}(1-a)}{158}$+$\frac{{m}_{1}a}{126}$;
点评 本题考查了物质组成的含量实验测定方法和过程分析,实验注意问题和减少误差的操作,元素守恒的计算应用,掌握基础是关键,题目难度中等.

| A. | KOH | B. | NaOH | C. | Ba(OH)2 | D. | Mg(OH)2 |
| A. | CO和SO2 | B. | 甲醛和苯等有机物 | ||
| C. | SO2和NO2 | D. | O3和Cl2 |
| A. | 稀硫酸 | B. | 三氧化硫 | C. | 铁 | D. | 硝酸铵 |
| A. | 将NaHCO3固体加入新制氯水,有无色气泡生成(H+) | |
| B. | 使红色布条褪色(HClO) | |
| C. | 向NaBr溶液中滴加氯水,再滴加CCl4,发现下层为橙红色(HCl) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加石蕊试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |