题目内容
【题目】化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。 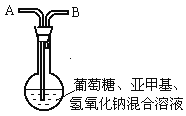
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
①从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
②在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
③为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2 , 都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:。
【答案】首先亚甲基蓝被葡萄糖还原为无色的亚甲基白,还原后的无色物质,又被空气中氧气氧化,又成为亚甲基蓝,反复作用。
【解析】亚甲基蓝在碱性溶液中很容易被葡萄糖还原为无色亚甲基白,振荡此无色溶液时,溶液与空气的接触面积增大,溶液中氧气的溶解量就增多,氧气把亚甲基白氧化为亚甲基蓝,溶液又呈蓝色。静置此溶液时有一部分溶解的氧气逸出,亚甲基蓝又被葡萄糖还原为亚甲基白,所以蓝色消失,变为无色。(1)烧瓶中取出溶液注满一支试管,塞上橡皮塞,试管内没有空气,故不能把亚甲基白氧化为亚甲基蓝,所以再振荡试管,溶液不能变蓝。

 英才计划期末调研系列答案
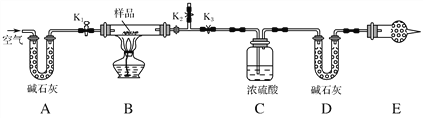
英才计划期末调研系列答案【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。