题目内容
15.常温下,下列各组数据中的比值小于2:1的是( )| A. | K2CO3溶液中c(K+)与c(CO32-)之比 | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 |
分析 A、碳酸根离子水解,其浓度减小;
B、醋酸是一元弱酸,电离程度很小,盐酸是一元强酸,完全电离;
C、(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-);
D、pH相同的KOH和Ba(OH)2溶液中氢氧根离子浓度相同,且都是强碱完全电离.
解答 解:A、K2CO3溶液中碳酸根离子水解,其浓度减小,所以c(K+)与c(CO32-)之比大于2:1,故A错误;
B、醋酸是一元弱酸,电离程度很小,盐酸是一元强酸,完全电离,所以0.2mol/L的CH3COOH溶液与0.1mol/L的盐酸中c(H+)之比小于2:1,故B正确;
C、(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),pH=7说明氢离子浓度=氢氧根离子浓度,c(NH4+)与c(SO42-)之比等于2:1,故C错误;
D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比等于2:1,故D错误;
故选B.
点评 本题考查了溶液中离子浓度大小比较,注意强弱电解质的区别和盐类水解,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.有4种碳骨架如下的烃,下列说法不正确的是( )

| A. | a和d互为同素异形体 | B. | b和c互为同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
3.以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图.下列说法正确的是( )


| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO${\;}_{3}^{2-}$ |
 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: 和
和 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类. ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯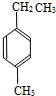 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯 .
.
 现有常温下的0.1mol/L小苏打溶液,回答下列问题:
现有常温下的0.1mol/L小苏打溶液,回答下列问题: .
.