题目内容
已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2Br
+10I-+12H+=5I2+Br2+6H2O
6Br
+5I-+6H+=5I
+3Br2+3H2O
②Br2能将I-氧化为I2:Br2+2I-═2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2.
I
+5I-+6H+=3I2+3H2O
2I
+10Br-+12H+=I2+5Br2+6H2O
(1)在上述反应涉及的粒子中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1mol KI的硫酸溶液中加KBrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br-中,则加入KBrO3的物质的量为 mol;
(4)将6mL 0.4mol?L-1KBrO3溶液和10mL0.4mol?L-1KI溶液在稀H2SO4中混合.写出发生反应的离子方程式 .
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2Br
| O | - 3 |
6Br
| O | - 3 |
| O | - 3 |
②Br2能将I-氧化为I2:Br2+2I-═2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2.
I
| O | - 3 |
2I
| O | - 3 |
(1)在上述反应涉及的粒子中氧化性最强的是
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为
(3)向含有1mol KI的硫酸溶液中加KBrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br-中,则加入KBrO3的物质的量为
(4)将6mL 0.4mol?L-1KBrO3溶液和10mL0.4mol?L-1KI溶液在稀H2SO4中混合.写出发生反应的离子方程式
考点:化学方程式的有关计算,氧化还原反应
专题:
分析:(1)利用氧化剂氧化性强于氧化产物氧化性进行判断;
(2)根据离子氧化性,可知KI和KBr的混合溶液中,加入过量的KBrO3,KBrO3能将KI氧化成KIO3,将Br-氧化成Br2,其本身被还原成Br2;
(3)根据电子转移守恒计算;
(4)6mL 0.4mol?L-1KBrO3溶液中KBrO3的物质的量=0.006L×0.4mol/L=2.4×10-3mol,若全部还原为Br2,可以获得电子为2.4×10-3mol×5=1.2×10-2mol,
10mL0.4mol?L-1KI溶液中KI物质的量=0.01L×0.4mol/L=4×10-3mol,若完全被氧化为KIO3,失去电子为4×10-3mol×6=2.4×10-2mol,若全部为氧化为I2,失去电子为4×10-3mol×1=4×10-3mol,
而4×10-3mol<1.2×10-2mol<2.4×10-2mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,设溶液中KIO3、I2的物质的量分别为xmol、ymol,根据I元素守恒及电子转移守恒计算,进而书写离子方程式.
(2)根据离子氧化性,可知KI和KBr的混合溶液中,加入过量的KBrO3,KBrO3能将KI氧化成KIO3,将Br-氧化成Br2,其本身被还原成Br2;
(3)根据电子转移守恒计算;
(4)6mL 0.4mol?L-1KBrO3溶液中KBrO3的物质的量=0.006L×0.4mol/L=2.4×10-3mol,若全部还原为Br2,可以获得电子为2.4×10-3mol×5=1.2×10-2mol,
10mL0.4mol?L-1KI溶液中KI物质的量=0.01L×0.4mol/L=4×10-3mol,若完全被氧化为KIO3,失去电子为4×10-3mol×6=2.4×10-2mol,若全部为氧化为I2,失去电子为4×10-3mol×1=4×10-3mol,
而4×10-3mol<1.2×10-2mol<2.4×10-2mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,设溶液中KIO3、I2的物质的量分别为xmol、ymol,根据I元素守恒及电子转移守恒计算,进而书写离子方程式.
解答:
解:(1)①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2,则氧化性:KBrO3>KIO3,
②Br2能将I-氧化为I2,则氧化性Br2>I2,
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,则氧化性:KIO3>Br2,
所以氧化性最强的是KBrO3,
故答案为:BrO3-;
(2)根据离子氧化性,可知KI和KBr的混合溶液中,加入过量的KBrO3,KBrO3能将KI氧化成KIO3,将Br-氧化成Br2,其本身被还原成Br2,故氧化产物为KIO3、Br2,还原产物为Br2,
故答案为:KIO3、Br2;Br2;
(3)向含有1mol KI的硫酸溶液中加KBrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br-中,令加入KBrO3的物质的量为xmol,根据电子转移守恒有:1mol×1=xmol×[5-(-1)],解得x=
,
故答案为:
;
(4)6mL 0.4mol?L-1KBrO3溶液中KBrO3的物质的量=0.006L×0.4mol/L=2.4×10-3mol,若全部还原为Br2,可以获得电子为2.4×10-3mol×5=1.2×10-2mol,
10mL0.4mol?L-1KI溶液中KI物质的量=0.01L×0.4mol/L=4×10-3mol,若完全被氧化为KIO3,失去电子为4×10-3mol×6=2.4×10-2mol,若全部为氧化为I2,失去电子为4×10-3mol×1=4×10-3mol,
而4×10-3mol<1.2×10-2mol<2.4×10-2mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,设溶液中KIO3、I2的物质的量分别为xmol、ymol,则:
解得x=1.6×10-3,y=1.2×10-3
故n(BrO3-):n(I-):n(IO3-):n(I2)=2.4×10-3mol:4×10-3mol:1.6×10-3mol:1.2×10-3mol=6:10:4:3,反应离子方程式为:6BrO3-+10I-+12H+=4IO3-+3I2+3Br2+6H2O;
故答案为:6BrO3-+10I-+12H+=4IO3-+3I2+3Br2+6H2O.
②Br2能将I-氧化为I2,则氧化性Br2>I2,
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,则氧化性:KIO3>Br2,
所以氧化性最强的是KBrO3,
故答案为:BrO3-;
(2)根据离子氧化性,可知KI和KBr的混合溶液中,加入过量的KBrO3,KBrO3能将KI氧化成KIO3,将Br-氧化成Br2,其本身被还原成Br2,故氧化产物为KIO3、Br2,还原产物为Br2,
故答案为:KIO3、Br2;Br2;
(3)向含有1mol KI的硫酸溶液中加KBrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br-中,令加入KBrO3的物质的量为xmol,根据电子转移守恒有:1mol×1=xmol×[5-(-1)],解得x=
| 1 |
| 6 |
故答案为:
| 1 |
| 6 |
(4)6mL 0.4mol?L-1KBrO3溶液中KBrO3的物质的量=0.006L×0.4mol/L=2.4×10-3mol,若全部还原为Br2,可以获得电子为2.4×10-3mol×5=1.2×10-2mol,
10mL0.4mol?L-1KI溶液中KI物质的量=0.01L×0.4mol/L=4×10-3mol,若完全被氧化为KIO3,失去电子为4×10-3mol×6=2.4×10-2mol,若全部为氧化为I2,失去电子为4×10-3mol×1=4×10-3mol,
而4×10-3mol<1.2×10-2mol<2.4×10-2mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,设溶液中KIO3、I2的物质的量分别为xmol、ymol,则:
|
解得x=1.6×10-3,y=1.2×10-3
故n(BrO3-):n(I-):n(IO3-):n(I2)=2.4×10-3mol:4×10-3mol:1.6×10-3mol:1.2×10-3mol=6:10:4:3,反应离子方程式为:6BrO3-+10I-+12H+=4IO3-+3I2+3Br2+6H2O;
故答案为:6BrO3-+10I-+12H+=4IO3-+3I2+3Br2+6H2O.
点评:本题考查氧化还原反应基本概念、有关计算及氧化性比较等,注意氧化还原反应得失电子数目相等,(4)为易错点、难点,注意利用假设法判断反应产物,难点中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |
下列关于卤素的叙述正确的是( )
| A、卤素只以化合态存在于自然界中 |
| B、随核电荷数增加,单质熔沸点降低 |
| C、随核电荷数增加,单质氧化性增强 |
| D、单质与水反应的通式均为X2+H2O=HX+HXO |
 i.
i. j.
j. k.
k.
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
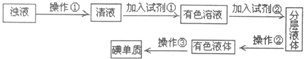
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行. 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)