题目内容
常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
| A.CO32-水解的平衡常数 |
| B.溶液的pH |
| C.溶液中HCO3-的数目 |
| D.溶液中的c(CO32-) |
C
解析试题分析:碳酸钠溶于水CO32-水解CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
考点:考查稀释对碳酸钠水解平衡的影响以及离子浓度变化判断

练习册系列答案
相关题目
常温下,用已知浓度的NaOH溶液滴定某浓度的弱酸HA,其滴定曲线如图所示,下列说法正确的是
| A.滴定时,可用酚酞作指示剂 |
| B.a点表示反应终点 |
| C.在b点时:c(Na+)>c(A—)>c(OH—)>c(H+) |
| D.在d点时:c(A—)= c(Na+)>c(OH—)=c(H+) |
根据以下叙述制备氯化铜:将含有FeO杂质的CuO粉末慢慢加入浓盐酸中,充分 反应后粉末溶解。已知:FeS不溶于水,但溶于强酸。
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
在除去溶液中的Fe2+时,可采用的方法是
A.加入纯铜粉,将Fe2+还原为Fe
B.直接加NaOH溶液,调整溶液的pH≥9.6
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3.7~4
D.通入H2S使Fe2+直接沉淀
下列关于电解质溶液的叙述正确的是( )
| A.在0.1 mol·L-1 NaHCO3溶液中:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3) |
| B.250C时,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
| C.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| D.将氨水和盐酸混合后,所得溶液中可能存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的溶解度一定小 |
在稀CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是
| A.加入水时,平衡左移 | B.加入少量0.1mol/LHCl溶液,溶液中c(H+)减小 |
| C.加入少量NaOH固体,平衡右移 | D.加入少量CH3COONa固体,平衡右移 |
关于NaHCO3溶液,下列表述不正确的是
| A.c (Na+)= c (HCO3-)+ c (CO32-)+ c (H2CO3) |
| B.c(Na+)+ c (H+)=" c" (HCO3-)+ c (CO32-)+ c (OH-) |
| C.HCO3-的水解程度大于HCO3-的电离程度 |
| D.c (H+) + c(H2CO3)=c (OH-)+ c(CO32-) |
某温度下,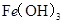
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液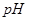 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D.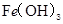 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |