题目内容
某温度下,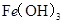
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液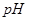 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D.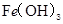 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
B
解析

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
| A.CO32-水解的平衡常数 |
| B.溶液的pH |
| C.溶液中HCO3-的数目 |
| D.溶液中的c(CO32-) |
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
水的电离过程为H2O H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
KW(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.氯化钠溶液中KW (35℃) <KW (25℃) | D.水的电离是吸热的过程 |
下列关于常温下电解质溶液的叙述中,正确的是( )
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1 |
水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是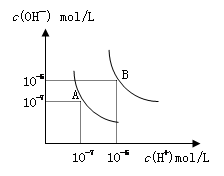
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
25℃时,在一定体积pH=12的Ba(OH)2溶液中,逐滴滴加一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后的溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1:9 | B.1:1 | C.1:2 | D.1:4 |
下列离子方程式正确的是( )
A.硫化钠水解 S2-+2H2O H2S+2OH- H2S+2OH- |
B.硫氢化钠的水解 HS-+H2O H3O++S2- H3O++S2- |
C.不断加热煮沸氯化铁溶液 Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
| D.硫酸铝溶液跟NaHCO3溶液反应 Al3++3HCO3-=Al(OH)3↓+3CO2↑ |