题目内容
17.取少量Fe2O3粉末,向其中加入适量盐酸使其充分溶解.(1)上述反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O反应后得到的溶液呈棕黄色.
(2)取少量上述溶液,置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,发生反应的化学方程式为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓此反应属于复分解 (填基本反应类型)反应.
(3)在甲烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 FeCl3 溶液,继续煮沸直至溶液呈红褐色,停止加热,即可以制得Fe(OH)3胶体.制备Fe(OH)3胶体的化学方程式:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HCl+Fe(OH)3胶体
(4)另取乙烧杯,加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,震荡均匀后,将乙烧杯与甲烧杯一起置于暗处,分别用激光笔照射烧杯中的液体,可以看到甲烧杯中的液体产生一条光亮的通路,这个实验可以用来区别胶体和溶液.
(5)取甲烧杯中的少量Fe(OH)3胶体于试管中,向试管中逐滴滴加稀盐酸,现象:先观察到沉淀,后沉淀溶解,原因:加入的盐酸是电解质,所以先使Fe(OH)3胶体聚沉,后发生酸碱中和反应,沉淀溶解,如果有反应,方程式为:Fe(OH)3+3HCl=FeCl3+3H2O.
分析 (1)反应生成氯化铁和水,铁离子为棕黄色;
(2)氯化铁与NaOH溶液反应生成红褐色的氢氧化铁沉淀,还生成NaCl;
(3)饱和氯化铁在沸水中水解生成胶体;
(4)丁达尔现象为胶体特有的性质;
(5)Fe(OH)3胶体中逐滴滴加稀盐酸,先发生聚沉,后沉淀溶解.
解答 解:(1)反应生成氯化铁和水,化学反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,反应后得到的溶液呈棕黄色,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;棕黄;
(2)氯化铁与NaOH溶液反应生成红褐色的氢氧化铁沉淀,还生成NaCl,反应为FeCl3+3NaOH=3NaCl+Fe(OH)3↓为复分解反应,
故答案为:红褐;FeCl3+3NaOH=3NaCl+Fe(OH)3↓;复分解;
(3)甲烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3 溶液,继续煮沸直至溶液呈红褐色,停止加热,即可以制得Fe(OH)3胶体.制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HCl+Fe(OH)3胶体,
故答案为:饱和;红褐;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HCl+Fe(OH)3胶体;
(4)甲为胶体分散系,乙为溶液,则分别用激光笔照射烧杯中的液体,可以看到甲烧杯中的液体产生一条光亮的通路,这个实验可以用来区别,
故答案为:甲;一条光亮的通路;胶体和溶液;
(5)取甲烧杯中的少量Fe(OH)3胶体于试管中,向试管中逐滴滴加稀盐酸,现象为先观察到沉淀,后沉淀溶解,原因为加入的盐酸是电解质,所以先使Fe(OH)3胶体聚沉,后发生酸碱中和反应,沉淀溶解,反应的方程式为Fe(OH)3+3HCl=FeCl3+3H2O,
故答案为:先观察到沉淀,后沉淀溶解;加入的盐酸是电解质,所以先使Fe(OH)3胶体聚沉,后发生酸碱中和反应,沉淀溶解;Fe(OH)3+3HCl=FeCl3+3H2O.
点评 本题考查元素化合物知识及反应原理,为高频考点,把握物质的性质、发生的反应及胶体的性质等是解答本题的关键,侧重分析与应用能力的考查,题目难度不大.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 麦芽糖、淀粉、纤维素都可以发生水解反应 | |
| D. | 油脂都不能使溴水褪色 |
| A. | 葡萄糖能与新制Cu(OH)2发生反应 | |
| B. | 肥皂是油脂在碱性条件下水解生成的 | |
| C. | “乙醇汽油”是汽油与乙醇生成的一种新型化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀不能重新溶于水 |

已知C的结构简式为
 .则:
.则:(1)高聚物H的结构简式是
 .
.(2)写出下列反应过程的反应类型:
| A→H | A→B | B→C | F→G | |
| 反应类型 |

(4)写出E转化为F的化学方程式
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$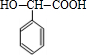 .
. | A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
