题目内容
在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的![]() ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为
[ ]
A.4:5
B.5:4
C.7:2
D.2:1
答案:AC
解析:
解析:
|
反应前:活塞两边气体均处于20℃,压强也相同,根据阿伏加德罗定律,右边混合气体的物质的量是N2的3倍. 反应后:活塞两边气体仍处于20℃,压强也相同,根据阿伏加德罗定律,右边剩余气体的物质的量与N2相等. 由于反应前后N2的体积虽然发生变化,但其物质的量没有改变,所以我们若假定N2为1mol时,H2和O2共3mol,反应后剩余气体即为1mol,那么混合气体从3mol变为1mol是什么原因造成的呢?是由以下反应引起的:2H2+O2 2H2+O2=2H2O 气体物质的量的减少 2 1 3 x y 3-1=2mol 显然:x= ①若氢气有剩余,则氧气的物质的量为 ②若氧气有剩余,则氢气的物质的量为 |

练习册系列答案
相关题目
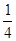 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________