题目内容
在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的![]() ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )
(A)4:5 (B)5:4 (C)7:2 (D)2:1
A、C
解析:
反应前:活塞两边气体均处于20℃,压强也相同,根据阿伏加德罗定律,右边混合气体的物质的量是N2的3倍。
反应后:活塞两边气体仍处于20℃,压强也相同,根据阿伏加德罗定律,右边剩余气体的物质的量与N2相等。
由于反应前后N2的体积虽然发生变化,但其物质的量没有改变,所以我们若假定N2为1mol时,H2和O2共3mol,反应后剩余气体即为1mol,那么混合气体从3mol变为1mol是什么原因造成的呢?是由以下反应引起的:2H2+O2![]() 2H2O(液),这是一个气体物质的量减少的反应。现假定参加反应的氢气和氧气分别为xmol和ymol,根据差量法可以确定x和y:
2H2O(液),这是一个气体物质的量减少的反应。现假定参加反应的氢气和氧气分别为xmol和ymol,根据差量法可以确定x和y:
2H2+O2=2H2O 气体物质的量的减少
2 1 3
x y 3-1=2mol
显然:x=![]() ,y=
,y=![]() 。x+y=2≠3,说明有气体剩余,那么剩余的1mol气体是什么呢?应该是氢气或氧气都有可能。讨论如下:
。x+y=2≠3,说明有气体剩余,那么剩余的1mol气体是什么呢?应该是氢气或氧气都有可能。讨论如下:
①若氢气有剩余,则氧气的物质的量为![]() mol,氢气的物质的量为:
mol,氢气的物质的量为:![]() +1=
+1=![]() mol,即体积比等于物质的量之比为7:2。
mol,即体积比等于物质的量之比为7:2。
②若氧气有剩余,则氢气的物质的量为![]() mol,氧气的物质的量为:
mol,氧气的物质的量为:![]() +1=
+1=![]() mol,即体积比等于物质的量之比为4:5。
mol,即体积比等于物质的量之比为4:5。
所以本题应选A、C。

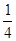 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________