题目内容
20.下列有关硫及其化合物的叙述正确的是( )| A. | 硫单质是一种淡黄色易溶于水的固体 | |
| B. | SO2的漂白原理与活性炭相同 | |
| C. | 可用澄清石灰水鉴别SO2和CO2 | |
| D. | 可用铁质或铝质容器储存浓硫酸 |
分析 A、硫单质难溶于水;
B.二氧化硫的漂白性是结合有色物质生成不稳定的无色物质,活性炭是吸附作用;
C.二氧化碳、二氧化硫气体和澄清石灰水都反应生成白色沉淀;
D.常温下铁和铝在浓硫酸溶液中发生钝化现象;
解答 解:A、硫单质是一种淡黄色难溶于水,微溶于酒精,易溶于二硫化碳的气体,故A错误;
B.二氧化硫的漂白性是结合有色物质生成不稳定的无色物质,活性炭是吸附作用,SO2的漂白原理与活性炭不相同,故B错误;
C.二氧化碳、二氧化硫气体和澄清石灰水都反应生成白色沉淀,CO2+Ca(OH)2=CaCO3↓+H2O,SO2+Ca(OH)2=CaSO3↓+H2O,故C错误;
D.常温下铁和铝在浓硫酸溶液中发生钝化现象,表面形成一薄层致密的氧化物薄膜阻止反应进行,可用铁质或铝质容器储存浓硫酸,故D正确;
故选D.
点评 本题考查了二氧化硫、二氧化碳、硫单质、浓硫酸等物质性质的分析应用,注意知识的积累,题目较简单.

练习册系列答案
相关题目
10.下列有关实验能达到实验目的是( )


| A. | 用图1所示装置可除去CO2中的HCl | |
| B. | 用图2装置制取并收集干燥纯净的Cl2 | |
| C. | 用图3所示装置将铁保护的方法称为牺牲阳极的阴极保护法 | |
| D. | 用图4装置可分离水和苯,且水层从分液漏斗下口放出 |
11.下列叙述正确的是( )
| A. | CaCO3不溶于水,所以CaCO3不是电解质 | |
| B. | 分解反应不一定是氧化还原反应 | |
| C. | 盐、碱一定含有金属元素 | |
| D. | 在水溶液中电离产生H+的化合物一定是酸 |
8.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列说法正确的是( )
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为非极性分子 | |
| C. | BF3分子中的B原子满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
5.在溶液中能大量共存的一组离子是( )
| A. | K+、H+、ClO-、CO3- | B. | NH4+、K+、OH-、NO3- | ||
| C. | H+、Mg2+、MnO4-、SO42- | D. | Fe3+、Na+、I-、Cl- |
12.下列离子能满足相应要求的是( )
| 选项 | 离子组 | 要求 |
| A | K+、CO32-、SO42-、Cl- | c(K+)<c(Cl-) |
| B | Na+、CO32-、NO3-、I- | 滴加盐酸立刻有气体生成 |
| C | Mg2+、Cl-、Na+、SO42- | 滴加氨水立刻有沉淀生成 |
| D | NH4+、SO42-、Na+、H+ | 滴加烧碱溶液立刻有气体生成 |
| A. | A | B. | B | C. | C | D. | D |
9.利用表中提供的仪器和药品,能达到相应实验目的是( )
| 选项 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、玻璃棒、胶头滴管 | FeCl3溶液、NaOH溶液 | 制Fe(OH)3胶体 |
| B | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的二氧化碳、蒸馏水 | 模拟喷泉实验 |
| C | 酸式滴定管、锥形瓶、铁架台(带铁夹) | 已知浓度的盐酸,待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、蒸发皿、三脚架 | NaCl溶液 | 蒸发溶液得到晶体 |
| A. | A | B. | B | C. | C | D. | D |
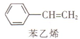
 .
.
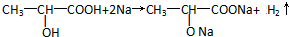 .
.