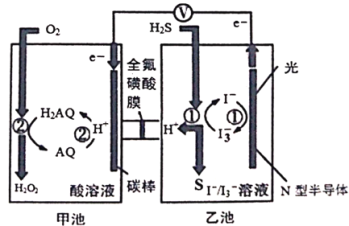
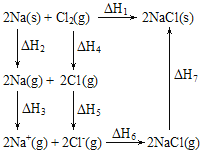
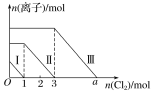
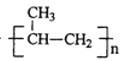题目内容
【题目】下列热化学方程式正确的是( )
选项 | 已知条件 | 热化学方程式 |
A | H2的燃烧热为a kJ·mol-1 | H2+Cl2 |
B | 1 mol SO2、0.5 mol O2完全反应,放出热量98.3 kJ | 2SO2(g)+O2(g) ΔH=-98.3 kJ·mol-1 |
C | H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 | H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 |
D | 31 g白磷比31 g红磷能量多b kJ | P4(白磷,s)=4P(红磷,s)ΔH=-4b kJ·mol-1 |
A.AB.BC.CD.D
【答案】D
【解析】
A.燃烧热是指在101kPa下,1mol纯物质完全燃烧生成稳定氧化物时所放出的热量,H2完全燃烧后生成稳定的氧化物是H2O(l)而不是HCl,A项错误;
B.ΔH数值应与方程式中各物质的化学计量数相对应,故2SO2(g)+O2(g)![]() 2SO3(g) ΔH=
2SO3(g) ΔH=![]() ,B项错误;
,B项错误;
C.H2SO4与Ba(OH)2反应生成了BaSO4沉淀,也放出了热量,故反应中放出的热量应大于114.6 kJ·mol-1,C项错误;
D. 31g白磷的物质的量为0.25mol,ΔH数值应与方程式中各物质的化学计量数相对应,故白磷转化为红磷,放出热量为4b kJ·mol-1,D项正确;
答案选D。

【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D