题目内容
12. 某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:
某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:I.进行焰色反应实验,火焰为无色.
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀.
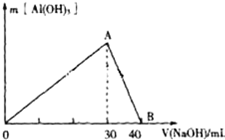
Ⅲ.取100mL废水,逐滴加入1.0mol/L的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如图所示.
请根据上述信息回答下列问题:
(1)该废水中一定不含有的离子是Fe3+、Na+、OH-.
(2)实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有:100mL容量瓶.
(3)写出图中A→B反应的离子方程式:OH-+Al(OH)3=AlO2-+2H2O.
(4)通过计算,该废水中含有Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=0.1mol/L(若不含有,此问不必作答).
分析 无色废水中不含Fe3+,
I.进行焰色反应实验,火焰为无色,说明无钠离子;
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀,说明溶液中含有硫酸根离子,而且物质的量为0.01mol;
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,说明溶液中含有铝离子,而铝离子的物质的量为:$\frac{1×0.03}{3}$=0.01mol,由此分析解答.
解答 解:无色废水中不含Fe3+,
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀,说明溶液中含有硫酸根离子,而且物质的量为0.01mol;
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,说明溶液中含有铝离子,而铝离子的物质的量为$\frac{1×0.03}{3}$=0.01mol,有铝离子就不含氢氧根离子,根据电荷守恒,含有氯离子,n(Cl-)=3n(Al3+)-2n(SO42-)=3×0.01-2×0.01=0.01mol,则:
(1)该废水中一定不含有的离子是Fe3+、Na+、OH-,故答案为:Fe3+、Na+、OH-;
(2)实验中需配制1.0mol•L-1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有100ml的容量瓶,
故答案为:100mL容量瓶;
(3)图中A→B反应是氢氧化铝溶解生成偏铝酸钠,离子方程方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为;OH-+Al(OH)3=AlO2-+2H2O;
(4)根据电荷守恒,该废水中含有Cl-;则c(Cl- )=$\frac{0.01}{0.1}$=0.1mol•L-1,故答案为:含有;0.1mol•L-1.
点评 本题是一道关于离子反应和离子检验知识的题目,考查学生分析和解决问题的能力,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | CaCl2 | B. | KOH | C. | H2O | D. | N2 |
| A. | 完全氧化56gFe需要消耗氯气33.6 L | |
| B. | 某浓度氢氧化钠溶液恰好溶解5.4g的铝,则被还原的水的分子数为0.6NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9 NA电子 |

 ,X2Y
,X2Y