题目内容
“物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( )
| A、质量相等的O2和O3,他们的物质的量之比为2:3 |
| B、1mol氧气的摩尔质量为32 |
| C、1mol任何物质都含有6.02×1023个原子 |
| D、2gH2含有1mol氢分子 |
考点:物质的量的相关计算
专题:
分析:A.由氧气和臭氧的摩尔质量,计算出质量相等的O2和O3的物质的量之比;
B.根据摩尔质量的单位为g/mol进行分析;
C.根据1mol任何物质都约含有6.02×1023个微粒进行分析;
D.根据n=
计算2克H2中含有的氢分子进行分析.
B.根据摩尔质量的单位为g/mol进行分析;
C.根据1mol任何物质都约含有6.02×1023个微粒进行分析;
D.根据n=
| m |
| M |
解答:
解:A.O2和O3的摩尔质量分别是32g/mol、48g/mol,设其质量均为m,质量相等的O2和O3,它们物质的量之比为
:
=3:2,故A错误;
B.摩尔质量是指1mol物质的质量,单位为g/mol,故摩尔质量之前不应再规定物质的量,故应为氧气的摩尔质量为32g/mol,故B错误;
C.1mol任何物质都约含有6.02×1023个微粒,不一定是分子,也有可以是离子或原子,故C错误;
D.2克H2中n=
=
=1mol,含有1mol氢分子,故D正确;
故选D.
| m |
| 32g/mol |
| m |
| 48g/mol |
B.摩尔质量是指1mol物质的质量,单位为g/mol,故摩尔质量之前不应再规定物质的量,故应为氧气的摩尔质量为32g/mol,故B错误;
C.1mol任何物质都约含有6.02×1023个微粒,不一定是分子,也有可以是离子或原子,故C错误;
D.2克H2中n=
| m |
| M |
| 2g |
| 2g/mol |
故选D.
点评:本题难度不大,考查学生对物质的量知识的理解与掌握及灵活应用进行解题的能力,解答本题要充分理解物质的宏观组成和微观构成的含义.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )
在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )| A、P1>P2>P3>P4 |
| B、甲醇的物质的量分数越高,反应的平衡常数越大 |
| C、若T1>T2>T3>T4,则该反应为放热反应 |
| D、T4、P4时,H2的平衡转化率为60% |
下列分子中所有原子都满足最外层8电子结构的是( )
| A、PCl5 |
| B、HClO |
| C、PCl3 |
| D、BF3 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1L1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子 |
分别在pH=1的酸和pH=13的NaOH溶液中加入足量的铝,放出的H2的量前者多,其原因可能是( )
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
| A、①④ | B、④ | C、②③ | D、③ |
下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A、2NO2(g)?N2O4(g)△H<0 |
| B、C(s)+CO2(g)?2CO(g)△H>0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0 |
| D、H2S(g)?H2(g)+S(s)△H>0 |
 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
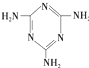 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有