题目内容
9.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 标准状况下,22.4L已烷含有的共价键总数为19NA | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移的电子数为2NA | |
| C. | 1L 0.1mol•-1 Na2CO3溶液中CO32-和HCO3-离子数之和为0.1NA | |
| D. | 密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数为NA |
分析 A.气体摩尔体积使用对象为气体;
B.依据Cu+2Fe3+=2Fe2++Cu2+判断;
C.碳酸氢根离子部分水解生成碳酸,依据碳原子个数守恒判断;
D.氢气与氮气合成氨气为可逆反应,依据可逆反应不能进行到底的特点解答.
解答 解:A.标况下己烷为液体,不能使用气体摩尔体积,故A错误;
B.依据Cu+2Fe3+=2Fe2++Cu2+,1mol铜被三价铁离子氧化生成1mol铜离子,转移2mol电子,个数为2NA,故B正确;
C.1L 0.1mol•-1 Na2CO3溶液中H2CO3、CO32-和HCO3-离子数之和为0.1NA,则溶液中CO32-和HCO3-离子数之和小于0.1NA,故C错误;
D.氢气与氮气合成氨气为可逆反应,可逆反应不能进行到底,所以密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数小于NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,质量换算物质的量计算,微粒数、共价键数、电子数、微粒个数的计算,题目较简单,注意气体摩尔体积的条件应用和对象.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
20.下列有关物质用途的说法错误的是( )
| A. | 过氧化钠可用作潜艇里氧气的来源 | |
| B. | 新制的氯水需保存在棕色玻璃瓶中 | |
| C. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 | |
| D. | 纯碱可用于治疗胃酸过多 |
17.下列电离方程式错误的是( )
| A. | HCl═H++Cl- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaHSO4═Na++H++SO42- |
4.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 阴离子的还原性:Y2-<Z- | ||
| C. | 离子半径:X+>W3+ | D. | 氢化物的稳定性:H2Y>HZ |
14.设NA为阿伏伽德罗常数的值,下列有关草酸(HOOC-COOH)的说法错误的是( )
| A. | 9.0g草酸中共用电子对数目为0.9NA | |
| B. | 9.0g草酸被NaClO氧化生成CO2,转移的电子数为0.2NA | |
| C. | 9.0g草酸溶于水,其中C2O${\;}_{4}^{2-}$和HC2O${\;}_{4}^{-}$的微粒数之和为0.1NA | |
| D. | 9.0g草酸受热完全分解为CO2、CO、H2O,标准状况下测得生成的气体体积为4.48L |
1.下列说法错误的是( )
| A. | 用新制的氢氧化铜不能区分乙醇,乙酸 | |
| B. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 | |
| C. | 近日,南充周边地市发生人感染H7N9禽流感病毒病例,该病毒可被高温和紫外线杀灭,利用了蛋白质变性的原理 | |
| D. | CH4和C10H22互为同系物 |
18.在周期表中,X元素与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种短周期元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 原子半径:rW<rX<rY | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中,Z的最高价氧化物对应水化物的酸性最强 |
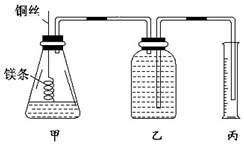 某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示: