题目内容
9.下列离子方程式书写正确的是( )①少量Cl2通入FeI2溶液中:Cl2+2I-═2Cl-+I2
②Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O
③向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO
④FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2
⑤向小苏打溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O
⑥硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O
⑦Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑
| A. | ①②⑤⑦ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
分析 ①碘离子的还原性强于亚铁离子,少量氯气只氧化碘离子;
②Fe(OH)3溶于氢碘酸,除发生中和反应外,还发生氧化还原反应生成碘化亚铁、碘;
③次氯酸钙中氯为+1价,具有氧化性,向次氯酸钙溶液中通入少量SO2发生氧化还原反应生成硫酸钙;
④氯气先氧化亚铁离子,后氧化溴离子,选项中遵循电子、电荷守恒;
⑤小苏打完全反应,生成碳酸钙、NaOH和水;
⑥硫酸氢钠完全反应,生成硫酸钡、水、NaOH;
⑦原子不守恒.
解答 解:①少量Cl2通入FeI2溶液中的离子反应为Cl2+2I-═2Cl-+I2,故①正确;
②Fe(OH)3溶于氢碘酸的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故②错误
③向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++2ClO-+H2O+SO2═CaSO4↓+H++Cl-+HClO,故③错误
④FeBr2溶液与等物质的量Cl2反应的离子反应为2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故④正确;
⑤向小苏打溶液中加入过量的澄清石灰水的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故⑤正确;
⑥硫酸氢钠溶液与足量氢氧化钡溶液混合的离子反应为H++SO42-+Ba2++OH-═BaSO4↓+H2O,故⑥正确;
⑦Na2O2与H2O反应制备O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故⑦错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式及电子、电荷守恒,题目难度中等.

练习册系列答案
相关题目
19.下列各图象的说法中正确的是( )
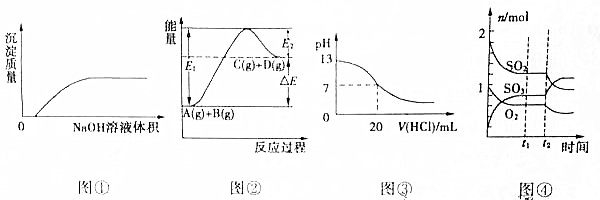

| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的条件可能是降低温度或缩小容器体积 |
17.屠呦呦因发现了青蒿素这种抗疟良药而获得2015年诺贝尔奖,这充分说明了“化学让人们生活更美好”.下列不属于化学反应在生活中的应用的是( )
| A. | 将氧化铁添加到油漆中制红色油漆 | B. | 用氯气给自来水消毒 | ||
| C. | 将粘土烧制成精美的瓷器 | D. | 用食醋清洗水壶中的水垢 |
4.下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
| A. | 只有①②④⑤ | B. | 只有①②⑤ | C. | 只有②⑤ | D. | 只有②④⑥ |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
1.下列关于有机物的说法正确的是( )
| A. |  的分子式为C7H12O 的分子式为C7H12O | |
| B. |  的所有原子一定在同一平面上 的所有原子一定在同一平面上 | |
| C. |  能发生还原反应、氧化反应和取代反应 能发生还原反应、氧化反应和取代反应 | |
| D. |  的二氯代物有15种 的二氯代物有15种 |
18.下列说法正确的是,( NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1摩氦气含有的原子数为2NA | |
| C. | 在常温常压下,32克氧气所含原子数目为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化:
 .
. .
. .
. (写出一种即可)
(写出一种即可)
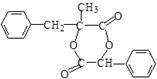 .
. .
.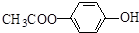 和
和 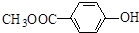 .
. ) 的合成线路
) 的合成线路 .
.