题目内容
19.下列各图象的说法中正确的是( )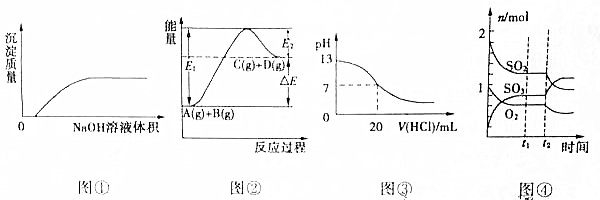
| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的条件可能是降低温度或缩小容器体积 |
分析 A.氢氧化钠与碳酸氢钡反应生成碳酸钡和碳酸钠;
B.图②表示反应物总能量低于生成物总能量,为吸热反应;
C.20mL0.1mol/LNaOH溶液PH为13,加入盐酸发生反应生成氯化钠,1mol盐酸消耗1mol氢氧化钠据此解答;
D.反应中转化量之比等于计量系数之比.
解答 解:A.氢氧化钠与碳酸氢钡反应生成碳酸钡和碳酸钠,加入氢氧化钠立刻产生沉淀,故A错误;
B.图②表示反应物总能量低于生成物总能量,为吸热反应,吸热反应断键吸收能量大于成键释放能量,故B错误;
C.20mL0.1mol/LNaOH溶液PH为13,加入盐酸发生反应生成氯化钠,1mol盐酸消耗1mol氢氧化钠,当加入0.1mol/L盐酸20mL,恰好中和,溶液呈中性,继续滴加盐酸,溶液显酸性pH减小,故C正确;
D.由图④可知时,0-t1时,二氧化硫、三氧化硫变化量为3mol,氧烧菜气变化量为2mol,二氧化硫、氧气、三氧化硫三者转化量之比为3:2:3,与方程式计量系数不成比例,所以图不能正确表示各组分的变化,故D错误;
故选:C.
点评 本题为图象题,明确物质之间发生的反应,反应热效应与反应物、生成物总能量之间的关系、影响平衡的因素是解题关键,题目难度中等.

练习册系列答案
相关题目
7.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,K2O,C4H10 | B. | CH4,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
4.除去下列混合物中的少量杂质(括号内的物质为杂质)所选试剂主要仪器及操作方法都合理的是( )
| 选项 | 样品(杂质) | 加入试剂主 | 要仪器 | 主要操作方法 |
| A | Fe2O3(Al2O3) | NaOH溶液 | 长颈漏斗 | 过滤、洗涤 |
| B | NaCl(NH4Cl) | Ca(OH)2 | 试管 | 加热 |
| C | 乙醇(水) | CaO | 蒸馏烧瓶 | 蒸馏 |
| D | NaCl溶液(Br2) | 乙醇 | 分液漏斗 | 萃取、蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
11.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.5L 1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
8.下列有机物分离提纯的方法正确的是( )
| A. | 除去苯中少量苯酚,加入适量浓溴水,过滤 | |
| B. | 除去乙烷中的乙烯,把混合气体通入酸性高锰酸钾溶液中 | |
| C. | 除去丁醇中的乙醚,用蒸馏法 | |
| D. | 提纯蛋白质时可先加入(CH3COO)2Pb溶液,过滤后再加水重新溶解 |






 :
: ;
; ;
; .
.